Κυκλοπροπάνιο: Διαφορά μεταξύ των αναθεωρήσεων
Χωρίς σύνοψη επεξεργασίας |
|||
| Γραμμή 99: | Γραμμή 99: | ||
}} |
}} |
||
Το '''κυκλοπροπάνιο''' είναι |
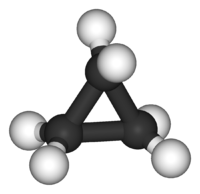
Το '''κυκλοπροπάνιο''' είναι το απλούστερο [[κυκλοαλκάνια|κυκλοαλκάνιο]], δηλαδή κορεσμένος [[υδρογονάνθρακες|υδρογονάνθρακας]] με ένα δακτύλιο ανά [[μόριο]]. Το μόριό του περιέχει τρία (3) άτομα [[άνθρακας|άνθρακα]] που σχηματίζουν τριμελή δακτύλιο. Καθένα από αυτά τα άτομα άνθρακα είναι ενωμένα με δύο (2) άτομα [[υδρογόνο|υδρογόνου]]]. Ο [[χημικός τύπος]] του είναι C<sub>3</sub>H<sub>6</sub>, οπότε έχει ένα (1) [[ισομέρεια|ισομερές θέσης]], το [[προπένιο]]. |
||
Με βάση το συνοπτικό χημικό τύπο, C<sub>3</sub>H<sub>6</sub>, είναι [[ισομέρεια|ισομερές θέσης]] με το [[προπένιο]], από το οποίο διαφέρει πολύ στις ιδιότητες. |
|||
Το κυκλοπροπάνιο είναι ένα [[αναισθητικό]] όταν εισπνέεται. Στη σύγχρονη αναισθητική πρακτική έχει ξεπεραστεί από άλλα αναισθητικά μέσα και αποφεύγεται η χρήση του για το σκοπό αυτό, γιατί η εξαιρετική του δραστικότητα, υπό κανονικές συνθήκες, το καθιστούν επικίνδυνο. Άλλωστε όταν το [[αέριο]] αυτό αναμιγνύεται με οξυγόνο, υπάρχει σημαντικός ένας κίνδυνος [[έκρηξη|έκρηξης]]. |
|||
Τα '''κυκλοπροπάνια''' είναι κατηγορία οργανικών ενώσεων. Κυκλοπροπάνια ονομάζονται όλα τα κυκλοαλκάνια που έχουν τριμελή δακτύλιο. Η κατηγορία δηλαδή περιλαμβάνει το κυκλπροπάνιο καθώς και όλες τις άλλες ενώσεις με περισσότερα άτομα άνθρακα που έχουν δακτύλιο κυκλοπροπανίου. |
Τα '''κυκλοπροπάνια''' είναι κατηγορία οργανικών ενώσεων. Κυκλοπροπάνια ονομάζονται όλα τα κυκλοαλκάνια που έχουν τριμελή δακτύλιο. Η κατηγορία δηλαδή περιλαμβάνει το κυκλπροπάνιο καθώς και όλες τις άλλες ενώσεις με περισσότερα άτομα άνθρακα που έχουν δακτύλιο κυκλοπροπανίου. |
||
== Ονοματολογία == |
== Ονοματολογία == |
||
| Γραμμή 109: | Γραμμή 111: | ||
== Δομή == |
== Δομή == |
||
Οι [[χημικός δεσμός|χημικοί δεσμοί]] μεταξύ των ατόμων άνθρακα του κυκλοπροπανίου είναι σχετικά ασθενέσθεροι από τους τυπικούς δεσμούς C-C, δίνοντάς του χημική δραστικότητα συγκρίσιμη μ' αυτή των [[αλκένια|αλκενίων]]. Η [[θεωρία παραμόρφωσης του Μπάυερ]] εξηγεί γιατί: Η [[γωνία]] C-C-C είναι 60°, δηλαδή πολύ μικρότερη από την κανονική γωνία δεσμών σ 2sp<sup>3</sup>-2sp<sup>3</sup>, που είναι περίπου 109.5°. Το γεγονός αυτό δίνει στο μόριο μια αυξημένη [[ενέργεια]] («ενέργεια τάσης δεσμών»), που εκφράζεται τελικά με την αυξημένη δραστικότητα του κυκλοπροπανίου, σε σχέση τόσο με τα [[αλκάνια]], όσο και με τα άλλα κυκλοαλκάνια, όπως το [[κυκλοεξάνιο]] και το [[κυκλοπεντάνιο]], που έχουν μηδενική (0) ή σχεδόν μηδενική ενέργεια τάσης δεσμών. Η ενέργεια τάσης δεσμών προέρχεται όχι μόνο από τη γωνιακή παραμόρφωση, που αναφέρθηκε παραπάνω, αλλά και παραμόρφωση στρέψης, αφού η ύπαρξη του δακτυλίου παρεμποδίζει την ελεύθερη περιστροφή των δεσμών C-C κι έτσι εμποδίζει και τη δημιουργία «εκλειπτικής διαμόρφωσης» μεταξύ των ατόμων υδρογόνου διαφορετικών ατόμων άνθρκα, ώστε να μειωθούν οι μεταξύ τους απώσεις<ref>Τα άτομα υδρογόνου έχουν ομώνυμο στατιστικό ηλεκτρικό φορτίο περίπου +0,03, οπότε απωθούνται.</ref>. Ωστόσο υπάρχει και μια αύξηση της σταθερότητας του δεσμού C-C, από το γεγονός ότι τελικά ο δεσμός αυτός έχει και κάποιο χαρακτήρα έξτρα δεσμού π, όπως υποδεικνύεται από την [[τροχιακό|τροχιακή]] περιγραφή του μορίου από τον Walsh, όπου μοντελοποιείται η ύπαρξη ενός τροχιακού συνδυασμού τριών (3) κέντρων των τριών (3) μεθυλενίων από τα οποία αποτελείται το μόριο. Κυρτωμένοι δεσμοί («δεσμοί μπανάνα») χρησιμοποιήθηκαν επίσης για να περιγράψουν τη δεσμική δομή του κυκλοπροπανίου. |
|||
Η απλούστερη πολυκυκλική ένωση που περιέχει πολλαπλούς συμπυκνωμένους δακτυλίους πολυπροπανίου είναι το [[τετραεδράνιο]], που το μόριό του αποτελείται από τέσσερεις (4) κυκλοπροπανικούς δακτυλίους που σχηματίζουν τις έδρες ενός [[τετράεδρο|τετραέδρου]]. Ακόμη, το [[(1,1,1)-προπελλάνιο|[1.1.1]-προπελάνιο]] περιέχει τρεις (3) κυκλοπροπανικούς δακτυλίους που μοιράζονται ένα κοινό κεντρικό ζεύγος ατόμων άνθρακα και το δεσμό τους. |
|||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
| Γραμμή 131: | Γραμμή 137: | ||
|} |
|} |
||
</div> |
</div> |
||
| ⚫ | |||
| ⚫ | «'''Κυκλοπροπάνια'''» ονομάζονται τα κυκλοαλκάνια με τριμελή δακτύλιο, που αποτελεί και το χαρακτηριστικό της δομής τους. Οι πλευρικές αλυσίδες, όταν υπάρχουν, διαμορφώνονται όπως στα [[αλκάνια]]. Το ιδιαίτερο χαρακτηριστικό της μοριακής δομής τους είναι η εμφάνιση γωνίας δεσμού <math> \mathrm{\widehat{C-C-C} = 60^o < 109^o28'} </math> που είναι η συνηθισμένη γωνία δεσμού sp<sup>3</sup>-sp<sup>3</sup> που αντιστοιχεί σε κορεσμένο. Ύστερα από ενεργειακή ανάλυση των πιθανών δομών - μοριακών μοντέλων με κβαντομηχανικές μεθόδους προέκυψε ως πιθανότερη η εκδοχή του sp<sup>2</sup> υβριδισμού και της δημιουργίας δύο μοριακών τροχιακών τριών κέντρων (των τριών ατόμων C), σ (2sp<sup>2</sup>-2sp<sup>2</sup>-2sp<sup>2</sup>) και π (2p-2p-2p), με 3 ηλεκτρόνια ανά μοριακό τροχιακό, ώστε να χρησιμοποιηθούν τα 6 διαθέσιμα ηλεκτρόνια των 3 ατόμων C (τα άλλα 6 χρησιμοποούνται για τους 6 σ δεσμούς με τα 6 άτομα υδρογόνου ή και τα αλκύλια). Αντί δηλαδή των κλασσικών 3 ομοιοπολικών δεσμών δύο κέντρων μεταξύ των ατόμων C, υπάρχουν 2 ομοιοπολικοί δεσμοί τριών κέντρων.<ref>Ν. Αλεξάνδρου, ''Γενική Οργανική Χημεία'', ΘΕΣΣΑΛΟΝΙΚΗ 1985: Σελ.127-128, §6.2.</ref> |
||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | Εξαιτίας αυτού του γεγονότος προκύπτει η λεγόμενη «'''ενέργεια τάσης δεσμών'''» που συνυπολογίζει την ενέργεια παραμόρφωσης δεσμικής γωνίας (κατά Baeyer), που οφείλεται στη διαφορά γωνίας από την κανονική, και την ενέργεια στρέψης (κατά Piltzer), που οφείλεται στην αδυναμία του συστήματος να στρέψει τους δεσμούς του και να πάρει διαμόρρφωση αποφυγής των απώσεων τύπου Van der Waals, που αναπτύσσονται από την προσέγγιση αλληλοαπωθούμενων ατόμων και ομάδων αυτών. Ενώ λοιπόν το [[ισομέρεια|ισομερές]] [[προπένιο]] έχει θερμότητα ολικής καύσης 1.971 kcal/mole το κυκλοπροπάνιο έχει 2.088 kcal/mole. Το ΔQ = 117 kJ/mole αντιστοιχεί ακριβώς στην επιπλέον ενέργεια που παγιδεύει η ιδιάζουσα δομή του τριμελή δακτυλίου.<ref>Ν. Αλεξάνδρου, Γενική Οργανική Χημεία, ΘΕΣΣΑΛΟΝΙΚΗ 1985, Σελ. 125-126, §6.1.</ref> |
||
| ⚫ | |||
== Παραγωγή == |
== Παραγωγή == |
||
| Γραμμή 276: | Γραμμή 291: | ||
* Παλαιότερα χρησιμοποιήθηκε ως αναισθητικό αλλά αποσύρθηκε ως ιδιαίτερα επικίνδυνο. Τώρα παράγεται κυρίως για συνθετικούς σκοπούς. |
* Παλαιότερα χρησιμοποιήθηκε ως αναισθητικό αλλά αποσύρθηκε ως ιδιαίτερα επικίνδυνο. Τώρα παράγεται κυρίως για συνθετικούς σκοπούς. |
||
| ⚫ | |||
| ⚫ | «'''Κυκλοπροπάνια'''» ονομάζονται τα κυκλοαλκάνια με τριμελή δακτύλιο, που αποτελεί και το χαρακτηριστικό της δομής τους. Οι πλευρικές αλυσίδες, όταν υπάρχουν, διαμορφώνονται όπως στα [[αλκάνια]]. Το ιδιαίτερο χαρακτηριστικό της μοριακής δομής τους είναι η εμφάνιση γωνίας δεσμού <math> \mathrm{\widehat{C-C-C} = 60^o < 109^o28'} </math> που είναι η συνηθισμένη γωνία δεσμού sp<sup>3</sup>-sp<sup>3</sup> που αντιστοιχεί σε κορεσμένο. Ύστερα από ενεργειακή ανάλυση των πιθανών δομών - μοριακών μοντέλων με κβαντομηχανικές μεθόδους προέκυψε ως πιθανότερη η εκδοχή του sp<sup>2</sup> υβριδισμού και της δημιουργίας δύο μοριακών τροχιακών τριών κέντρων (των τριών ατόμων C), σ (2sp<sup>2</sup>-2sp<sup>2</sup>-2sp<sup>2</sup>) και π (2p-2p-2p), με 3 ηλεκτρόνια ανά μοριακό τροχιακό, ώστε να χρησιμοποιηθούν τα 6 διαθέσιμα ηλεκτρόνια των 3 ατόμων C (τα άλλα 6 χρησιμοποούνται για τους 6 σ δεσμούς με τα 6 άτομα υδρογόνου ή και τα αλκύλια). Αντί δηλαδή των κλασσικών 3 ομοιοπολικών δεσμών δύο κέντρων μεταξύ των ατόμων C, υπάρχουν 2 ομοιοπολικοί δεσμοί τριών κέντρων.<ref>Ν. Αλεξάνδρου, ''Γενική Οργανική Χημεία'', ΘΕΣΣΑΛΟΝΙΚΗ 1985: Σελ.127-128, §6.2.</ref> |
||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | Εξαιτίας αυτού του γεγονότος προκύπτει η λεγόμενη «'''ενέργεια τάσης δεσμών'''» που συνυπολογίζει την ενέργεια παραμόρφωσης δεσμικής γωνίας (κατά Baeyer), που οφείλεται στη διαφορά γωνίας από την κανονική, και την ενέργεια στρέψης (κατά Piltzer), που οφείλεται στην αδυναμία του συστήματος να στρέψει τους δεσμούς του και να πάρει διαμόρρφωση αποφυγής των απώσεων τύπου Van der Waals, που αναπτύσσονται από την προσέγγιση αλληλοαπωθούμενων ατόμων και ομάδων αυτών. Ενώ λοιπόν το [[ισομέρεια|ισομερές]] [[προπένιο]] έχει θερμότητα ολικής καύσης 1.971 kcal/mole το κυκλοπροπάνιο έχει 2.088 kcal/mole. Το ΔQ = 117 kJ/mole αντιστοιχεί ακριβώς στην επιπλέον ενέργεια που παγιδεύει η ιδιάζουσα δομή του τριμελή δακτυλίου.<ref>Ν. Αλεξάνδρου, Γενική Οργανική Χημεία, ΘΕΣΣΑΛΟΝΙΚΗ 1985, Σελ. 125-126, §6.1.</ref> |
||
| ⚫ | |||
== Αναφορές και παρατηρήσεις == |
== Αναφορές και παρατηρήσεις == |
||
Έκδοση από την 23:12, 4 Μαρτίου 2013
| Κυκλοπροπάνιο | |||
|---|---|---|---|

| |||

| |||
| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Κυκλοπροπάνιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C3H6 | ||
| Μοριακή μάζα | 42,08 amu | ||
| Σύντομος συντακτικός τύπος |
|||
| Αριθμός CAS | 75-19-4 | ||
| SMILES | C1CC1 | ||
| InChI | 1/C3H6/c1-2-3-1/h1-3H2 | ||
| PubChem CID | 6351 | ||
| ChemSpider ID | 6111 | ||
| Δομή | |||
| Είδος δεσμού | C-H: σ(2sp2-1s) | ||
| Πόλωση δεσμού | C--H+: 3% | ||
| Μοριακή γεωμετρία | Τα ανθρακοάτομα σε επίπεδη τριγωνική θέση. | ||
| Ισομέρεια | |||
| Ισομερή θέσης | 1 Προπένιο | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | -128 °C | ||
| Σημείο βρασμού | -33 °C | ||
| Πυκνότητα | 1,879 kg/m3 (1 atm, 0°C) | ||
| Εμφάνιση | Άχρωμο αέριο | ||
| Χημικές ιδιότητες | |||
| Θερμότητα πλήρους καύσης |
2.088 kJ/mole | ||
| Επικινδυνότητα | |||

| |||
| Εξαιρετικά εύφλεκτο (F+) | |||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Το κυκλοπροπάνιο είναι το απλούστερο κυκλοαλκάνιο, δηλαδή κορεσμένος υδρογονάνθρακας με ένα δακτύλιο ανά μόριο. Το μόριό του περιέχει τρία (3) άτομα άνθρακα που σχηματίζουν τριμελή δακτύλιο. Καθένα από αυτά τα άτομα άνθρακα είναι ενωμένα με δύο (2) άτομα υδρογόνου]. Ο χημικός τύπος του είναι C3H6, οπότε έχει ένα (1) ισομερές θέσης, το προπένιο.
Το κυκλοπροπάνιο είναι ένα αναισθητικό όταν εισπνέεται. Στη σύγχρονη αναισθητική πρακτική έχει ξεπεραστεί από άλλα αναισθητικά μέσα και αποφεύγεται η χρήση του για το σκοπό αυτό, γιατί η εξαιρετική του δραστικότητα, υπό κανονικές συνθήκες, το καθιστούν επικίνδυνο. Άλλωστε όταν το αέριο αυτό αναμιγνύεται με οξυγόνο, υπάρχει σημαντικός ένας κίνδυνος έκρηξης.
Τα κυκλοπροπάνια είναι κατηγορία οργανικών ενώσεων. Κυκλοπροπάνια ονομάζονται όλα τα κυκλοαλκάνια που έχουν τριμελή δακτύλιο. Η κατηγορία δηλαδή περιλαμβάνει το κυκλπροπάνιο καθώς και όλες τις άλλες ενώσεις με περισσότερα άτομα άνθρακα που έχουν δακτύλιο κυκλοπροπανίου.
Ονοματολογία
Η ονομασία «κυκλοπροπάνιο» προέρχεται από την ονοματολογία κατά IUPAC. Συγκεκριμένα, το πρόθεμα της κύριας ονομασίας «προπ-» δηλώνει την παρουσία τριών (3) ατόμων άνθρακα ανά μόριο της ένωσης, το ενδιάμεσο «-αν-» δείχνει την παρουσία μόνο απλών δεσμών μεταξύ ατόμων άνθρακα στο μόριο και η κατάληξη «-ιο» φανερώνει ότι δεν περιέχει χαρακτηριστικές ομάδες, δηλαδή ότι είναι υδρογονάνθρακας. Το αρχικό πρόθεμα «κυκλο-» δηλώνει την παρουσία ενός (1) ισοκυκλικού δακτυλίου στο μόριο της ένωσης.
Δομή
Οι χημικοί δεσμοί μεταξύ των ατόμων άνθρακα του κυκλοπροπανίου είναι σχετικά ασθενέσθεροι από τους τυπικούς δεσμούς C-C, δίνοντάς του χημική δραστικότητα συγκρίσιμη μ' αυτή των αλκενίων. Η θεωρία παραμόρφωσης του Μπάυερ εξηγεί γιατί: Η γωνία C-C-C είναι 60°, δηλαδή πολύ μικρότερη από την κανονική γωνία δεσμών σ 2sp3-2sp3, που είναι περίπου 109.5°. Το γεγονός αυτό δίνει στο μόριο μια αυξημένη ενέργεια («ενέργεια τάσης δεσμών»), που εκφράζεται τελικά με την αυξημένη δραστικότητα του κυκλοπροπανίου, σε σχέση τόσο με τα αλκάνια, όσο και με τα άλλα κυκλοαλκάνια, όπως το κυκλοεξάνιο και το κυκλοπεντάνιο, που έχουν μηδενική (0) ή σχεδόν μηδενική ενέργεια τάσης δεσμών. Η ενέργεια τάσης δεσμών προέρχεται όχι μόνο από τη γωνιακή παραμόρφωση, που αναφέρθηκε παραπάνω, αλλά και παραμόρφωση στρέψης, αφού η ύπαρξη του δακτυλίου παρεμποδίζει την ελεύθερη περιστροφή των δεσμών C-C κι έτσι εμποδίζει και τη δημιουργία «εκλειπτικής διαμόρφωσης» μεταξύ των ατόμων υδρογόνου διαφορετικών ατόμων άνθρκα, ώστε να μειωθούν οι μεταξύ τους απώσεις[1]. Ωστόσο υπάρχει και μια αύξηση της σταθερότητας του δεσμού C-C, από το γεγονός ότι τελικά ο δεσμός αυτός έχει και κάποιο χαρακτήρα έξτρα δεσμού π, όπως υποδεικνύεται από την τροχιακή περιγραφή του μορίου από τον Walsh, όπου μοντελοποιείται η ύπαρξη ενός τροχιακού συνδυασμού τριών (3) κέντρων των τριών (3) μεθυλενίων από τα οποία αποτελείται το μόριο. Κυρτωμένοι δεσμοί («δεσμοί μπανάνα») χρησιμοποιήθηκαν επίσης για να περιγράψουν τη δεσμική δομή του κυκλοπροπανίου.
Η απλούστερη πολυκυκλική ένωση που περιέχει πολλαπλούς συμπυκνωμένους δακτυλίους πολυπροπανίου είναι το τετραεδράνιο, που το μόριό του αποτελείται από τέσσερεις (4) κυκλοπροπανικούς δακτυλίους που σχηματίζουν τις έδρες ενός τετραέδρου. Ακόμη, το [1.1.1]-προπελάνιο περιέχει τρεις (3) κυκλοπροπανικούς δακτυλίους που μοιράζονται ένα κοινό κεντρικό ζεύγος ατόμων άνθρακα και το δεσμό τους.
| Δεσμοί[2] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C-H | σ | 2sp2-1s | 108,7 pm | 3% C- H+ |
| C-C-C | σ τριών ηλεκτρονίων και τριών κέντρων | 2sp2-2sp2-2sp2 | 151 pm (C-C) | |
| C-C-C | π τριών ηλεκτρονίων και τριών κέντρων | 2p-2p-2p | 151 pm (C-C) | |
| Κατανομή φορτίων σε ουδέτερο μόριο | ||||
| C | -0,06 | |||
| H | +0,03 | |||
Κυκλοπροπάνια
«Κυκλοπροπάνια» ονομάζονται τα κυκλοαλκάνια με τριμελή δακτύλιο, που αποτελεί και το χαρακτηριστικό της δομής τους. Οι πλευρικές αλυσίδες, όταν υπάρχουν, διαμορφώνονται όπως στα αλκάνια. Το ιδιαίτερο χαρακτηριστικό της μοριακής δομής τους είναι η εμφάνιση γωνίας δεσμού που είναι η συνηθισμένη γωνία δεσμού sp3-sp3 που αντιστοιχεί σε κορεσμένο. Ύστερα από ενεργειακή ανάλυση των πιθανών δομών - μοριακών μοντέλων με κβαντομηχανικές μεθόδους προέκυψε ως πιθανότερη η εκδοχή του sp2 υβριδισμού και της δημιουργίας δύο μοριακών τροχιακών τριών κέντρων (των τριών ατόμων C), σ (2sp2-2sp2-2sp2) και π (2p-2p-2p), με 3 ηλεκτρόνια ανά μοριακό τροχιακό, ώστε να χρησιμοποιηθούν τα 6 διαθέσιμα ηλεκτρόνια των 3 ατόμων C (τα άλλα 6 χρησιμοποούνται για τους 6 σ δεσμούς με τα 6 άτομα υδρογόνου ή και τα αλκύλια). Αντί δηλαδή των κλασσικών 3 ομοιοπολικών δεσμών δύο κέντρων μεταξύ των ατόμων C, υπάρχουν 2 ομοιοπολικοί δεσμοί τριών κέντρων.[3]
Εξαιτίας αυτού του γεγονότος προκύπτει η λεγόμενη «ενέργεια τάσης δεσμών» που συνυπολογίζει την ενέργεια παραμόρφωσης δεσμικής γωνίας (κατά Baeyer), που οφείλεται στη διαφορά γωνίας από την κανονική, και την ενέργεια στρέψης (κατά Piltzer), που οφείλεται στην αδυναμία του συστήματος να στρέψει τους δεσμούς του και να πάρει διαμόρρφωση αποφυγής των απώσεων τύπου Van der Waals, που αναπτύσσονται από την προσέγγιση αλληλοαπωθούμενων ατόμων και ομάδων αυτών. Ενώ λοιπόν το ισομερές προπένιο έχει θερμότητα ολικής καύσης 1.971 kcal/mole το κυκλοπροπάνιο έχει 2.088 kcal/mole. Το ΔQ = 117 kJ/mole αντιστοιχεί ακριβώς στην επιπλέον ενέργεια που παγιδεύει η ιδιάζουσα δομή του τριμελή δακτυλίου.[4] Αποτέλεσμα των παραπάνω είναι τα κυκλοπροπάνια να δείνουν αντιδράσεις κυκλοπροσθήκης-1,3.
Παραγωγή
Ενδομοριακή αντίδραση Würz
Ιστορικά πρωτοπαρασκευάστηκε από τον August Freund το 1881 με τη χρήση ενδομοριακής αντίδρασης Würtz, από 1,3-διβρωμοπροπάνιο[5][6]
- Όμως η απόδοση αυτής της αντίδρασης είναι σχετικά μικρή, αφού ταυτόχρονα διεξάγεται αναπόφευκτα και διαμοριακή[7]:
- Σήμερα χρησιμοποιείται περισσότερο η τροποποιημένη αντίδραση Freund με Zn, που δίνει μεγαλύτερη απόδοση στην ενδομοριακή αντίδραση. Σ' αυτήν την περίπτωση η στοιχειομετρική εξίσωση της αντίδρασης γίνεται[8][9]:
Αιθένιο και μεθυλένιο
Λόγω της τάσης χρήσης του αιθενίου ως κεντρική πρώτη ύλη της οργανικής χημείας, επικράτησε περισσότερο η προσθήκη του κατάλληλου καρβενίου σ' αυτό, δηλαδή του μεθυλενίου, που παράγεται επί τόπου από CH3Cl και KOH. Η στοιχειομετρική εξίσωση της αντίδρασης είναι[10]:
- Επειδή η αντίδραση αυτή δίνει και προϊόν παρεμβολής (~80%) προπένιο, χρησιμοποιείται η ακόλουθη που δίνει (σχεδόν) αποκλειστικά κυκλοπροπάνιο[11]:
Χημικές ιδιότητες
- Τα κυκλοαλκάνια με τριμελή δακτύλιο (δηλαδή τα «κυκλοπροπάνια») έχουν αρκετή ενέργεια τάσης δεσμών για να δώσουν προσθηκοδιάσπαση-1,3, αλλά κάτω από πιο έντονες συνθήκες και με μικρότερη ταχύτητα αντίδρασης σε σχέση με τα αλκένια. Κατά τα άλλα συμπεριφέρονται χημικά όπως τα αλκάνια[12]:
- Ο όρος «κυκλοπροσθήκη» σημαίνει διάσπαση δακτυλίου και προσθήκη στα άκρα της αλυσίδας που προκύπτει.
Οξείδωση
1. Όπως όλα τα κυκλοαλκάνια, το κυκλοπροπάνιο με περίσσεια οξυγόνου καίγεται προς διοξείδιο του άνθρακα και νερό[13][14]:
2. Παραγωγή υδραερίου:
3. Καταλυτική οξείδωση:
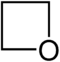
- 1. Χωρίς κυκλοπροσθήκη προς κυκλοπροπανόνη:
- 2. Με πιο έντονες συνθήκες δίνει κυκλοπροσθήκη-1,3, σχηματίζοντας οξετάνιο:
Αλογόνωση
1. Φωτοχημική αλογόνωση υποκατάστασης υδρογόνου: Το κυκλοπροπάνιο έχει 6 ισότμα άτομα υδρογόνου για φωτοχημική αντικατάσταση από αλογόνα, οπότε προκύπτει ένα μόνο κυκλοπροπυλαλογονίδιο[18]:
- Δραστικότητα των X2: F2 > Cl2 > Br2 > Ι2.
Ανάλυση του μηχανισμού της χλωρίωσης του κυκλοπροπανίου:
- 1. Έναρξη: Παράγονται ελεύθερες ρίζες:
- Η απαιτούμενη ενέργεια προέρχεται από το υπεριώδες φως (UV) ή θερμότητα (Δ).
- 2. Διάδοση: Καταναλώνονται οι παλιές ελεύθερες ρίζες, σχηματίζοντας νέες.
- 3. Τερματισμός: Καταναλώνονται μεταξύ τους οι ελεύθερες ρίζες, κατά τη στατιστικά σπάνια περίπτωση της συνάντησής τους.
- Είναι όμως πρακτικά δύσκολο να σταματήσει η αντίδραση στην παραγωγή μονοαλογονοπαραγώγων.
- Αν χρησιμοποιηθούν ισομοριακές ποσότητες
 και Χ2 θα παραχθεί μίγμα όλων των X-παραγώγων του
και Χ2 θα παραχθεί μίγμα όλων των X-παραγώγων του 
- Αν όμως χρησιμοποιηθει περίσσεια
 , τότε η απόδοση τωμ μονοπαραγώγων αυξάνεται πολύ, λόγω της αύξησης της στατιστική πιθανότητας συνάντισης
, τότε η απόδοση τωμ μονοπαραγώγων αυξάνεται πολύ, λόγω της αύξησης της στατιστική πιθανότητας συνάντισης  με X. σε σχέση με την πιθανότητα συνάντισης μονοπαραγώγου και X., που μπορεί να οδηγήσει στην παραγωγή των υπόλοιπων X-παραγώγων.
με X. σε σχέση με την πιθανότητα συνάντισης μονοπαραγώγου και X., που μπορεί να οδηγήσει στην παραγωγή των υπόλοιπων X-παραγώγων.
- Αν χρησιμοποιηθούν ισομοριακές ποσότητες
2. Κυκλοπροσθήκη-1,3 παράγεται 1,3-διαλοπροπάνιο:
Επίδραση καρβενίων
- Το κυκλοπροπάνιο έχει 6 ισότμα άτομα υδρογόνου για παρεμβολή καρβενίων, οπότε προκύπτει ένα μόνο προϊόν. Π.χ. με επίδρση μεθυλενίου παράγεται μεθυλοκυκλοπροπάνιο[20]:
Νίτρωση
Καταλυτική 1,3-υδρογόνωση
Με καταλυτική υδρογόνωση - Παράγεται προπάνιο:
Υδραλογόνωση-1,3
Με υδραλογόνο (ΗΧ) - Παράγεται προπυλοαλογονίδιο:
Υδροξυαλογόνωση-1,3
Με υπαλογονώδες οξύ (HOX) - Παράγεται 3-αλο-1-προπανόλη:
Ενυδάτωση-1,3
Με επίδραση θειικού οξέως σε κυκλοπροπάνιo παράγεται ο μονοπροπυλεστέρας του θειικού οξέος, που υδρολύεται σχηματίζοντας 1-προπανόλη:
Διυδροξυλίωση-1,3
Με επίδραση υπεροξείδιο του υδρογόνου σε κυκλοπροπάνιo, παρουσία καρβονικών οξέων παράγεται 1,3-προπανoδιόλη:
Χρήσεις
- Παλαιότερα χρησιμοποιήθηκε ως αναισθητικό αλλά αποσύρθηκε ως ιδιαίτερα επικίνδυνο. Τώρα παράγεται κυρίως για συνθετικούς σκοπούς.
Αναφορές και παρατηρήσεις
- ↑ Τα άτομα υδρογόνου έχουν ομώνυμο στατιστικό ηλεκτρικό φορτίο περίπου +0,03, οπότε απωθούνται.
- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
- ↑ Ν. Αλεξάνδρου, Γενική Οργανική Χημεία, ΘΕΣΣΑΛΟΝΙΚΗ 1985: Σελ.127-128, §6.2.
- ↑ Ν. Αλεξάνδρου, Γενική Οργανική Χημεία, ΘΕΣΣΑΛΟΝΙΚΗ 1985, Σελ. 125-126, §6.1.
- ↑ August Freund (1881). "Über Trimethylen". Journal für Praktische Chemie 26 (1): 625–635. doi:10.1002/prac.18820260125.
- ↑ August Freund (1882). "Über Trimethylen". Monatshefte für Chemie 3 (1): 625–635. doi:10.1007/BF01516828.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.2.
- ↑ G. Gustavson (1887). "Ueber eine neue Darstellungsmethode des Trimethylens". J. Prakt. Chem. 36: 300–305. doi:10.1002/prac.18870360127. http://gallica.bnf.fr/ark:/12148/bpt6k90799n/f308.table.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 154, §6.5.Β1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 154, §6.5.Β2 και 157, §6.8.7.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, σελ. 138, §9.2Β5β.
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ.24, §1.2.
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ.21, §1.1.
- ↑ Ν. Αλεξάνδρου, Γενική Οργανική Χημεία, ΘΕΣΣΑΛΟΝΙΚΗ 1985: Σελ.126, 6.1.
- ↑ ΔHC-C= +347 kJ/mol
- ↑ ΔHC-H = +415 kJ/mol
- ↑ ΔHO-O=+146 kJ/mol
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, σελ. 43-46 §4.4.3.
- ↑ καθοριστικό ταχύτητας
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, σελ. 46 §4.4.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ. 244, §10.3.2.
Πηγές
- Ν. Αλεξάνδρου, Γενική Οργανική Χημεία, ΘΕΣΣΑΛΟΝΙΚΗ 1985
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
| Στο λήμμα αυτό έχει ενσωματωθεί κείμενο από το λήμμα Cyclopropane της Αγγλικής Βικιπαίδειας, η οποία διανέμεται υπό την GNU FDL και την CC-BY-SA 4.0. (ιστορικό/συντάκτες). |










![{\displaystyle \mathrm {+3H_{2}O{\xrightarrow[{700-1100^{o}C}]{Ni}}3CO+6H_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/4092ba3a99c06c6660e229ed6517eb6aa67c6ac2)
![{\displaystyle \mathrm {+O_{2}{\xrightarrow[{\triangle }]{Cu}}H_{2}O+} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/5ad0e766c90ff9dd6d78efd9e1c5ab564423ca9e)
![{\displaystyle \mathrm {+{\frac {1}{2}}O_{2}{\xrightarrow[{1-2MPa,\;280^{o}C}]{Ag}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/d7c6afaa463770e8f338d24528e88bab69cf21d9)
![{\displaystyle \mathrm {+X_{2}{\xrightarrow[{\triangle }]{UV}}HX+} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/32d971c77e4c7bf3933a6b8058fff314dd3f149a)
![{\displaystyle \mathrm {Cl_{2}{\xrightarrow[{\triangle }]{UV}}2Cl^{\bullet }-239kJ} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/73fe9c8e7397e9e50d5b5a7ea91a25e26bed2f96)















![{\displaystyle \mathrm {+H_{2}SO_{4}{\xrightarrow {}}CH_{3}CH_{2}CH_{2}OSO_{3}H{\xrightarrow[{-H_{2}SO_{4}}]{+H_{2}O}}CH_{3}CH_{2}CH_{2}OH} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/c7eb661ef73415051303afa182b8fab34848af08)
