Συζήτηση:Καρκίνος του πνεύμονα
Σχόλιο 2012[επεξεργασία κώδικα]
Υπάρχει ως καρκίνος του πνεύμονα.--The Elder (συζήτηση) 17:38, 20 Νοεμβρίου 2012 (UTC)
Το άρθρο με τίτλο Καρκίνος των πνευμόνων το μορφοποιούμε μια ομάδα φοιτητών στα πλαίσια μια εργασίας για ένα επιλεγόμενο μάθημα. Καθώς θα αξιολογηθούμε για αυτή μας την προσπάθεια σκεφτόμαστε μήπως το άρθρο αυτό θα μας επιτρέπατε να μείνει για ένα μικρό διάστημα με τη δομή που έχει (θα ανεβάσουμε και πρόσθετο υλικό) μέχρι να ελεγχθεί το πόνημα. Στη συνέχεια θα χαιρόμασταν να συνεισφέρει το άρθρο μας στο ήδη υπάρχον πάνω στο θέμα. — ανυπόγραφο σχόλιο του χρήστη Nantia Pap (συζήτηση • συνεισφορά) 20:38, 21 Νοεμβρίου 2012 UTC-5.
Κανένα πρόβλημα από εμένα. Ελπιδοφόρο το έργο σας--The Elder (συζήτηση) 22:09, 20 Νοεμβρίου 2012 (UTC)--The Elder (συζήτηση) 22:09, 20 Νοεμβρίου 2012 (UTC)
Ευχαριστούμε πολύ για την κατανόηση!!! — ανυπόγραφο σχόλιο του χρήστη Nantia Pap (συζήτηση • συνεισφορά) 19:38, 21 Νοεμβρίου 2012 UTC-5.
New translation[επεξεργασία κώδικα]
We have a newer translation of this article. I have attached below. Not sure if it is of use.
| Καρκίνος του πνεύμονα | |
|---|---|
 A plane chest X-ray showing a tumor in the lung (marked by arrow) | |
| Ταξινόμηση | |
| ICD-10 | C33-C34 |
| ICD-9 | 162 |
| DiseasesDB | 7616 |
| MedlinePlus | 007194 |
| eMedicine | med/1333 med/1336 emerg/335 radio/807 radio/405radio/406 |
| MeSH | D002283 |
Ο καρκίνος του πνεύμονα είναι μια ασθένεια που χαρακτηρίζεται από ανεξέλεγκτη κυτταρική αύξηση στους ιστούς των πνευμόνων. Εάν δεν εφαρμοστεί κάποια θεραπεία, η αύξηση μπορεί να εξαπλωθεί και πέραν του πνεύμονα, μέσω μιας διαδικασίας που ονομάζεται μετάσταση, στον κοντινό ιστό ή σε άλλα μέρη του σώματος. Οι περισσότεροι καρκίνοι που εκδηλώνονται στον πνεύμονα, γνωστοί ως πρωτογενείς καρκίνοι του πνεύμονα, είναι καρκινώματα που προέρχονται από επιθηλιακά κύτταρα. Οι κύριες μορφές καρκίνου του πνεύμονα είναι ο μικροκυτταρικός καρκίνος του πνεύμονα (SCLC), που ονομάζεται επίσης καρκίνος κυττάρων βρόμης, και ο μη μικροκυτταρικός καρκίνος του πνεύμονα (NSCLC). Τα πιο συνηθισμένα συμπτώματα είναι ο βήχας (όπως και ο βήχας με αίμα), η απώλεια βάρους και η δυσκολία στην αναπνοή.[1]
Η πιο κοινή αιτία καρκίνου του πνεύμονα είναι η μακροχρόνια έκθεση στον καπνό του τσιγάρου,[2] που προκαλεί το 80–90% των καρκίνων του πνεύμονα.[1] Οι μη καπνιστές αντιπροσωπεύουν το 10–15% των περιπτώσεων καρκίνου του πνεύμονα,[3] και οι περιπτώσεις αυτές συχνά αποδίδονται σε έναν συνδυασμό γενετικών παραγόντων,[4] αέριου ραδονίου,[4] αμιάντου,[5] και ατμοσφαιρικής ρύπανσης,[4] όπως επίσης και δευτερογενούς καπνίσματος.[6][7] Ο καρκίνος του πνεύμονα μπορεί να εντοπιστεί με ακτινογραφία θώρακα και αξονική τομογραφία. Η διάγνωση επιβεβαιώνεται μέσω βιοψίας[8] που συνήθως εκτελείται με βρογχοσκόπηση ή μέσω απεικονιστικού ελέγχου με αξονική τομογραφία. Η θεραπεία και τα μακροχρόνια αποτελέσματα εξαρτώνται από τη μορφή του καρκίνου, το στάδιο (βαθμός εξάπλωσης) και τη γενική κατάσταση υγείας του ατόμου, η οποία μετράται με την κατάσταση ικανότητας.
Στις κοινές θεραπείες περιλαμβάνονται η χειρουργική επέμβαση, η χημειοθεραπεία και η ακτινοθεραπεία. Ο μη μικροκυτταρικός καρκίνος του πνεύμονα (NSCLC) αντιμετωπίζεται ενίοτε με χειρουργική επέμβαση, ενώ ο μη μικροκυτταρικός καρκίνος του πνεύμονα (NSCLC) ανταποκρίνεται συνήθως καλύτερα στη χημειοθεραπεία και την ακτινοθεραπεία.[9] Συνολικά, το 15% των ατόμων που έχουν διαγνωστεί με καρκίνο του πνεύμονα στις Ηνωμένες Πολιτείες επιβιώνει πέντε χρόνια μετά τη διάγνωση.[10] Σε παγκόσμιο επίπεδο, ο καρκίνος του πνεύμονα είναι η πιο κοινή αιτία θανάτου από καρκίνο σε άντρες και γυναίκες και ευθύνεται για 1,38 εκατομμύρια θανάτους ετησίως, από το 2008.[11]
Ενδείξεις και συμπτώματα[επεξεργασία κώδικα]
Στις ενδείξεις και τα συμπτώματα που μπορεί να παραπέμπουν σε καρκίνο του πνεύμονα περιλαμβάνονται:[1]
- συμπτώματα στην αναπνοή: βήχας, βήχας με αίμα, συριγμός ή δυσκολία στην αναπνοή
- συστημικά συμπτώματα: απώλεια βάρους, πυρετός, παραμόρφωση του σχήματος των νυχιών στα χέρια ή κόπωση
- συμπτώματα που οφείλονται σε τοπική πίεση: πόνος στο στήθος, πόνος στα οστά, σύνδρομο άνω κοίλης φλέβας, δυσκολία στην κατάποση
Εάν ο καρκίνος αναπτυχθεί στον αεραγωγό, μπορεί να εμποδίζει τη ροή του αέρα, προκαλώντας δυσκολίες στην αναπνοή. Η αναπνευστική δυσχέρεια μπορεί να προκαλέσει συσσώρευση εκκρίσεων πίσω από την απόφραξη και προδιάθεση για πνευμονία.[1]
Ανάλογα με το είδος του όγκου, τα επονομαζόμενα παρανεοπλασματικά φαινόμενα μπορεί να γεννήσουν υπόνοιες για την ύπαρξη της νόσου.[12] Στον καρκίνο του πνεύμονα, στα παραπάνω φαινόμενα μπορεί να περιλαμβάνονται το μυασθενικό-μυοπαθητικό σύνδρομο Lambert-Eaton (μυϊκή αδυναμία οφειλόμενη σε αυτοαντισώματα), η υπερασβεστιαιμία ή το σύνδρομο ακατάλληλης έκκρισης αντιδιουρητικής ορμόνης (SIADH). Οι όγκοι στο ανώτερο τμήμα του πνεύμονα, γνωστοί ως όγκοι(-ος) του Pancoast, μπορεί να προσβάλουν το τοπικό τμήμα του συμπαθητικού νευρικού συστήματος και να οδηγήσουν σε σύνδρομο Horner (βλεφαρόπτωση και σμίκρυνση της κόρης του ματιού), καθώς και σε βλάβες στο βραχιόνιο πλέγμα.[1]
Πολλά από τα συμπτώματα του καρκίνου του πνεύμονα (ανορεξία, απώλεια βάρους, πυρετός, κόπωση) δεν είναι σαφή.[8] Σε πολλά άτομα, ο καρκίνος έχει ήδη εξαπλωθεί πέρα από το αρχικά προσβαλλόμενο σημείο, όταν πια εκδηλώσουν συμπτώματα και αναζητήσουν ιατρική βοήθεια. Στα συνήθη σημεία εξάπλωσης περιλαμβάνεται ο εγκέφαλος, τα οστά, ο/οι επινεφριδικός(-οί) αδένας(-ες), ο δεύτερος πνεύμονας, το συκώτι, το περικάρδιο και το/τα νεφρό(-α).[13] Ποσοστό περίπου 10% των ατόμων με καρκίνο του πνεύμονα δεν παρουσιάζουν συμπτώματα κατά τη διάγνωση• οι καρκίνοι αυτοί ανιχνεύονται κατά σύμπτωση στις ακτινογραφίες θώρακα, που διενεργούνται στα πλαίσια εξετάσεων ρουτίνας.[10]
Αίτια[επεξεργασία κώδικα]
Ο καρκίνος αναπτύσσεται μετά από γενετικές βλάβες στο DNA. Η γενετική βλάβη επηρεάζει τις κανονικές λειτουργίες του κυττάρου, όπως και τον πολλαπλασιασμό των κυττάρων, τον προγραμματισμένο κυτταρικό θάνατο (απόπτωση) και την επανόρθωση του DNA. Όσο περισσότερες βλάβες συσσωρεύονται, τόσο αυξάνεται ο κίνδυνος για καρκίνο.[14]
Κάπνισμα[επεξεργασία κώδικα]
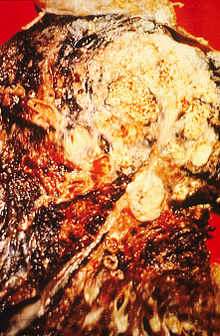
Το κάπνισμα, και ιδίως του τσιγάρου, αποτελεί μακράν το κύριο αίτιο καρκίνου του πνεύμονα.[15] Ο καπνός του τσιγάρου περιέχει πάνω από 60 γνωστές καρκινογόνες ουσίες,[16] όπως ραδιοϊσότοπα από τη διαδικασία διάσπασης του [[ραδόνιο|ραδονίου], νιτροσαμίνη και βενζοπυρένιο. Επιπρόσθετα, η νικοτίνη φαίνεται να καταστέλλει την ανοσολογική απόκριση του εκτεθειμένου ιστού σε καρκινικές νεοπλασίες.[17] Σε όλο τον ανεπτυγμένο κόσμο, κατά τη διάρκεια του έτους 2000, το 90% των θανάτων από καρκίνο του πνεύμονα στους άνδρες έχει αποδοθεί στο κάπνισμα (70% για τις γυναίκες).[18] Το κάπνισμα ευθύνεται για το 80–90% των περιπτώσεων καρκίνου του πνεύμονα.[1]
Παθητικό κάπνισμα— η εισπνοή του καπνού τρίτων συνιστά μία από τις αιτίες καρκίνου του πνεύμονα σε μη καπνιστές. Ως «παθητικός καπνιστής» χαρακτηρίζεται κάποιος που ζει ή εργάζεται μαζί με έναν καπνιστή. Μελέτες στις ΗΠΑ,[19][20]την Ευρώπη,[21] το Ηνωμένο Βασίλειο,[22] και την Αυστραλία[23] κατέδειξαν σημαντικά αυξημένο κίνδυνο σε άτομα που εκτίθενται σε παθητικό κάπνισμα.[24] Τα άτομα που συζούν με κάποιον καπνιστή διατρέχουν κατά 20–30% αυξημένο κίνδυνο, ενώ τα άτομα που εργάζονται σε περιβάλλον δευτερογενούς καπνίσματος διατρέχουν αυξημένο κίνδυνο κατά 16–19%.[25] Έρευνες στο παράπλευρο ρεύμα καπνού του τσιγάρου καταδεικνύουν ότι είναι πιο επικίνδυνο από το ενεργητικό κάπνισμα.[26] Το παθητικό κάπνισμα ευθύνεται για περίπου 3.400 θανάτους από καρκίνο του πνεύμονα κάθε χρόνο στις ΗΠΑ.[20]
Αέριο ραδόνιο[επεξεργασία κώδικα]
Το ραδόνιο είναι ένα άχρωμο και άοσμο αέριο που παράγεται από τη διάσπαση του ραδιενεργού ραδίου, που με τη σειρά του είναι το προϊόν διάσπασης του ουρανίου, το οποίο βρίσκεται στον φλοιό της Γης. Τα προϊόντα διάσπασης της ακτινοβολίας προκαλούν ιονισμό του γενετικού υλικού, καθώς και επακόλουθες μεταλλάξεις που μερικές φορές μπορεί να είναι καρκινογόνες. Το ραδόνιο είναι η δεύτερη πιο κοινή αιτία καρκίνου του πνεύμονα στις ΗΠΑ, μετά το κάπνισμα.[20] Ο κίνδυνος αυξάνεται αναλογικά κατά 8–16% για κάθε αύξηση στη συγκέντρωση του ραδονίου κατά 100 Bq/m³.[27]Τα επίπεδα αέριου ραδονίου ποικίλουν ανάλογα με την τοποθεσία και τη σύνθεση των πετρωμάτων και του υποκείμενου εδάφους. Για παράδειγμα, σε περιοχές όπως η Κορνουάλη στο Ηνωμένο Βασίλειο (όπου τα υποστρώματα του εδάφους έχουν σα βάση τον γρανίτη), το αέριο ραδόνιο συνιστά σημαντικό πρόβλημα και επιβάλλεται να χρησιμοποιούνται ανεμιστήρες για τον αερισμό των κτιρίων, προκειμένου να μειώνονται οι συγκεντρώσεις αέριου ραδονίου. Η Υπηρεσία Προστασίας Περιβάλλοντος των ΗΠΑ (EPA) εκτιμά ότι 1 στα 15 σπίτια στις ΗΠΑ εμφανίζει ποσοστά ραδονίου πάνω από το επιτρεπόμενο όριο των 4 picocurie ανά λίτρο (pCi/l) (148 Bq/m³).[28]
Αμίαντος[επεξεργασία κώδικα]
Ο αμίαντος μπορεί να προκαλέσει διάφορες ασθένειες στους πνεύμονες, συμπεριλαμβανομένου του καρκίνου του πνεύμονα. Το κάπνισμα και ο αμίαντος έχουν συνεργική δράση στο σχηματισμό καρκίνου του πνεύμονα.[5] Ο αμίαντος μπορεί επίσης να προκαλέσει καρκίνο του υπεζωκότα, που ονομάζεται μεσοθηλίωμα (και είναι διαφορετικός από τον καρκίνο του πνεύμονα).[29]
Ατμοσφαιρική ρύπανση[επεξεργασία κώδικα]
Η ατμοσφαιρική ρύπανση έχει περιορισμένη επίδραση στην αύξηση του κινδύνου για καρκίνο του πνεύμονα.[4] Τα λεπτόκοκκα σωματίδια (PM2.5), καθώς και τα θειικά αερολύματα που απελευθερώνονται από τις εξατμίσεις των αυτοκινήτων, συσχετίζονται με ελαφρώς αυξημένο κίνδυνο.[4][30] Όσον αφορά το διοξείδιο του αζώτου, μια στοιχειώδης αύξηση 10 μερών ανά δισεκατομμύριο αυξάνει τον κίνδυνο καρκίνου των πνευμόνων κατά 14%.ref>Clapp, RW; Jacobs MM, Loechler EL (Jan-Mar 2008). «Environmental and Occupational Causes of Cancer New Evidence, 2005–2007». Reviews on Environmental Health 23 (1): 1–37. PMID 18557596. PMC 2791455. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2791455/?tool=pubmed.</ref> Υπολογίζεται ότι η ατμοσφαιρική ρύπανση ευθύνεται για το 1–2% των καρκίνων του πνεύμονα.[4]
Σε προκαταρκτικά πορίσματα υποστηρίζεται η άποψη ότι υπάρχει αυξημένος κίνδυνος για καρκίνο του πνεύμονα από τη ρύπανση του αέρα σε εσωτερικούς χώρους που οφείλεται στην καύση ξύλου, κάρβουνου, κοπριάς ή κατάλοιπων καλλιεργειών για το μαγείρεμα και τη θέρμανση.[31] Οι γυναίκες που εκτίθενται σε αναθυμιάσεις άνθρακα σε εσωτερικούς χώρους διατρέχουν περίπου διπλάσιο κίνδυνο, ενώ μια σειρά υποπροϊόντων καύσης βιομάζας θεωρούνται γνωστά ή ύποπτα καρκινογόνα.[32] Ο κίνδυνος αυτός επηρεάζει περίπου 2,4 δισεκατομμύρια ανθρώπους σε παγκόσμιο επίπεδο[31] και πιστεύεται ότι ευθύνεται για το 1,5% των θανάτων από καρκίνο του πνεύμονα.[32]
Γενετική[επεξεργασία κώδικα]
Υπολογίζεται ότι 8 με 14% των καρκίνων του πνεύμονα αποδίδεται σε κληρονομικούς παράγοντες.[33] Ο κίνδυνος αυξάνεται κατά 2,4 φορές σε συγγενείς ασθενών με καρκίνο του πνεύμονα. Αυτό πιθανόν να οφείλεται σε κάποιον συνδυασμό γονιδίων.[34]
Άλλα αίτια[επεξεργασία κώδικα]
Πολλές άλλες ουσίες, μερικά επαγγέλματα καθώς και η έκθεση σε ορισμένους περιβαλλοντικούς παράγοντες έχουν συνδεθεί με τον καρκίνο του πνεύμονα. Σύμφωνα με το Διεθνή Οργανισμό για την Έρευνα του Καρκίνου (IARC) υπάρχουν επαρκή στοιχεία που αποδεικνύουν ότι οι παρακάτω παράγοντες ευνοούν την καρκινογένεση στους πνεύμονες:[35]
- Ορισμένα μέταλλα (όπως η παραγωγή αλουμινίου, το κάδμιο , οι ενώσεις του καδμίου, το χρώμιο, οι ενώσεις του εξασθενούς χρωμίου [Cr (VI)], το βηρύλλιο και οι ενώσεις βηρυλλίου, η χύτευση σιδήρου και χάλυβα, οι ενώσεις νικελίου, το αρσενικό, οι ανόργανες ενώσεις του αρσενικού και η υπόγεια εξόρυξη αιματίτη)
- Ορισμένα προϊόντα καύσης (όπως η ατελής καύση, ο άνθρακας (οι εκπομπές από την καύση άνθρακα σε εσωτερικούς χώρους), η αεριοποίηση του άνθρακα, η πισσάσφαλτος, η παραγωγή οπτάνθρακα, η αιθάλη, τα καυσαέρια πετρελαιοκινητήρων)
- Η ιονίζουσα ακτινοβολία (όπως η ακτινοβολία χ, το ραδόνιο-222 και τα προϊόντα διάσπασής του, η ακτινοβολία γ, το πλουτώνιο)
- Ορισμένα τοξικά αέρια (όπως ο μεθυλαιθέρας (τεχνικής καθαρότητας), ο διχλωρομεθυλαιθέρας, ο θειούχος υπερίτης, το μείγμα MOPP (μείγμα βινκριστίνης-πρεδνισόνης-αζωτούχου υπερίτη και προκαρβαζίνης), οι αναθυμιάσεις βαφών)
- Η παραγωγή καουτσούκ και η κρυσταλλική σκόνη χαλαζία
Παθογένεση[επεξεργασία κώδικα]
Όπως και σε πολλά άλλα είδη καρκίνου, η ανάπτυξη του καρκίνου του πνεύμονα διεγείρεται είτε μέσω της ενεργοποίησης ογκογονιδίων είτε μέσω της απενεργοποίησης ογκοκατασταλτικών γονιδίων. [36] Πιστεύεται ότι τα ογκογονίδια καθιστούν τους ανθρώπους πιο επιρρεπείς στην ανάπτυξη καρκίνου. Εικάζεται, επίσης, ότι τα πρωτο-ογκογονίδια μετατρέπονται σε ογκογονίδια από τη στιγμή που εκτίθενται σε ορισμένες καρκινογόνες ουσίες.[37] Οι μεταλλάξεις του πρωτο-ογκογονιδίου K-ras ευθύνονται για το 10–30% των περιπτώσεων αδενοκαρκινώματος του πνεύμονα.[38][39] Ο υποδοχέας του επιδερμικού αυξητικού παράγοντα (epidermal growth factor receptor EGFR) ρυθμίζει τον πολλαπλασιασμό των κυττάρων, την απόπτωση, την αγγειογένεση και τη διήθηση του όγκου.[38] Οι μεταλλάξεις και ο πολλαπλασιασμός του EGFR είναι συνήθεις στο μικροκυτταρικό καρκίνωμα του πνεύμονα και παρέχουν τη βάση για θεραπεία με αναστολείς του EGFR. Το γονίδιο Her2/neu δεν επηρεάζεται τόσο συχνά.[38] Η χρωμοσωμική βλάβη μπορεί να οδηγήσει στην απώλεια της ετεροζυγωτίας. Αυτή η διαδικασία ενδέχεται να απενεργοποιήσει τη λειτουργία των ογκοκατασταλτικών γονιδίων. Βλάβες στα χρωμοσώματα 3p, 5q, 13q και 17p είναι ιδιαίτερα κοινές στο μικροκυτταρικό καρκίνωμα του πνεύμονα. Το ογκοκατασταλτικό γονίδιο p53 που εντοπίζεται στο χρωμόσωμα 17p επηρεάζεται στο 60-75% των περιπτώσεων.[40] Άλλα γονίδια τα οποία συχνά μεταλλάσσονται ή πολλαπλασιάζονται είναι τα: c-MET, NKX2-1,LKB1, PIK3CA και το BRAF.[38]
Διάγνωση[επεξεργασία κώδικα]

Η ακτινογραφία θώρακος είναι μία από τις πρώτες διερευνητικές εξετάσεις που γίνεται όταν ένα άτομο αναφέρει συμπτώματα που μπορεί να υποδηλώνουν καρκίνο του πνεύμονα. Μέσω της ακτινογραφίας μπορεί να αποκαλυφθεί η ύπαρξη μάζας, διεύρυνση του μεσοθωρακίου (ένδειξη εξάπλωσης στα εκεί λεμφογάγγλια ), ατελεκτασία (σύμπτωση του πνεύμονα), πνευμονική πύκνωση (πνευμονία) ή υπεζωκοτική συλλογή.[2] Η απεικόνιση μέσω υπολογιστικής τομογραφίας χρησιμοποιείται συνήθως για να παρέχει περισσότερες πληροφορίες σχετικά με τον τύπο και την έκταση της ασθένειας. Η βρογχοσκόπηση ή η βιοψία με τη βοήθεια της υπολογιστικής τομογραφίας διενεργείται συχνά για τη λήψη δείγματος του όγκου για ιστοπαθολογική εξέταση.[10]
Ο καρκίνος του πνεύμονα παρουσιάζεται συχνά κατά την εκτίμηση ακτινογραφία θώρακος με τη μορφή μονήρους πνευμονικού όζου. Η διαφορική διάγνωση, ωστόσο, είναι ευρεία. Πολλές άλλες ασθένειες μπορεί να παρουσιάζουν την ίδια εικόνα. Σε αυτές συμπεριλαμβάνονται η φυματίωση, οι μυκητιασικές λοιμώξεις, ο μεταστατικός καρκίνος ή η οργανούμενη πνευμονία. Στα λιγότερο συχνά αίτια του μονήρους πνευμονικού όζου συμπεριλαμβάνονται τα αμαρτώματα, οι βρογχογενείς κύστες, τα αδενώματα, η αρτηριοφλεβική δυσπλασία, το πνευμονικό απόλυμα, οι ρευματοειδείς όζοι, η κοκκιωμάτωση Wegener ή το λέμφωμα.[41] Η διάγνωση της ασθένειας μπορεί να αποτελεί και τυχαίο εύρημα που εμφανίζεται ως μονήρης πνευμονικός όζος σε ακτινογραφία θώρακος ή σε υπολογιστική τομογραφία που μπορεί να διενεργείται για άλλο λόγο.[42]Η οριστική διάγνωση του καρκίνου του πνεύμονα βασίζεται στην ιστολογική εξέταση του ύποπτου για καρκίνο ιστού στο πλαίσιο των κλινικών και ακτινολογικών ευρημάτων.[1]
Ταξινόμηση[επεξεργασία κώδικα]
| Ιστολογικός τύπος | επίπτωση ανά 100.000 ετησίως |
|---|---|
| Όλοι οι τύποι | 66.9 |
| Αδενοκαρκίνωμα | 22.1 |
| Καρκίνωμα πλακώδους επιθηλίου (ή ακανθοκυτταρικό καρκίνωμα) | 14.4 |
| Μικροκυτταρικό καρκίνωμα | 9.8 |
Ο καρκίνος του πνεύμονα ταξινομείται σύμφωνα με τον ιστολογικό τύπο.[8] Η ταξινόμηση είναι σημαντική για τον προσδιορισμό του τρόπου αντιμετώπισης και για να προβλεφθεί η έκβαση της ασθένειας. Στη συντριπτική πλειοψηφία των περιπτώσεων ο καρκίνος του πνεύμονα συνιστά καρκινώματα, δηλαδή κακοήθεις όγκους που προέρχονται από επιθηλιακά κύτταρα. Τα καρκινώματα που πνεύμονα ταξινομούνται βάσει του μεγέθους και της εμφάνισης των καρκινικών κυττάρων τα οποία εξετάζονται από τον ιστοπαθολόγο με τη βοήθεια μικροσκοπίου. Δύο είναι οι ευρείες κατηγορίες: το μη μικροκυτταρικό και το μικροκυτταρικό καρκίνωμα. [43]
Μη μικροκυτταρικό καρκίνωμα του πνεύμονα[επεξεργασία κώδικα]

Οι τρεις κύριοι υπότυποι του μη μικροκυτταρικού καρκινώματος είναι το αδενοκαρκίνωμα, το ακανθοκυτταρικό καρκίνωμα του πνεύμονα (ή καρκίνωμα πλακώδους επιθηλίου) και το μεγαλοκυτταρικό καρκίνωμα του πνεύμονα.[1]
Περίπου 40% των καρκίνων του πνεύμονα είναι αδενοκαρκινώματα, τα οποία συνήθως προέρχονται από περιφερικό ιστό των πνευμόνων.[8] Τα περισσότερα περιστατικά με αδενοκαρκίνωμα σχετίζονται με το κάπνισμα. Ωστόσο, ακόμη και σε άτομα που είχαν καπνίσει λιγότερα από 100 τσιγάρα κατά τη διάρκεια της ζωής τους (κι έχουν χαρακτηριστεί ως "ποτέ καπνιστές"),[1] το αδενοκαρκίνωμα αποτελεί την πιο συνηθισμένη μορφή καρκίνου του πνεύμονα.[44] Ένας υπότυπος του αδενοκαρκινώματος, το βρογχοκυψελιδικό καρκίνωμα, συναντάται συχνότερα σε γυναίκες "ποτέ καπνίστριες" και δείχνουν να έχουν καλύτερες πιθανότητες επιβίωσης μακροπρόθεσμα.[45]
Το καρκίνωμα πλακώδους επιθηλίου αφορά περίπου το 30% όλων των πνευμονικών καρκίνων. Κατά κανόνα εντοπίζεται κοντά στους μεγάλους αεραγωγούς. Στον πυρήνα του όγκου εντοπίζεται συχνά μια κοιλότητα που σχετίζεται μεκυτταρικό θάνατο. [8]Το μεγαλοκυτταρικό καρκίνωμα αφορά περίπου το 9% όλων των πνευμονικών καρκίνων. Ονομάζεται έτσι λόγω του μεγάλου μεγέθους των καρκινικών κυττάρων και επειδή παρουσιάζουν άφθονο κυτταρόπλασμα, μεγάλου μεγέθους πυρήνες και ευδιάκριτους πυρηνίσκους.[8]
Μικροκυτταρικό καρκίνωμα του πνεύμονα[επεξεργασία κώδικα]

Τα κύτταρα του μικροκυτταρικού καρκινώματος του πνεύμονα (SCLC) φέρουν πυκνά νευροεκκριτικά κοκκία (κυστίδια που περιέχουν νευροενδοκρινικές ορμόνες) και συσχετίζουν έτσι τον όγκο με ενδοκρινικό/παρανεοπλασματικό σύνδρομο.[46] Τα περισσότερα περιστατικά αναπτύσσονται στους μεγάλους αεραγωγούς (στελεχιαίοι και δευτερεύοντες βρόγχοι).[10]Αυτοί οι καρκίνοι αναπτύσσονται γρήγορα και μεθίστανται νωρίς. Στο 60% με 70% των ασθενών εντοπίζεται κατά την αρχική διάγνωση η ύπαρξη μεταστάσεων. Αυτός ο τύπος καρκίνου συνδέεται στενά με το κάπνισμα.[1]
Άλλοι τύποι[επεξεργασία κώδικα]
Οι αναγνωρισμένοι κύριοι ιστολογικοί υπότυποι είναι τέσσερις, ωστόσο σε ορισμένους τύπους μπορεί να εμπεριέχονται διάφοροι υπότυποι.[43] Στους σπάνιους υπότυπους συμπεριλαμβάνονται οι όγκοι των αδένων, οι καρκινοειδείς όγκοι καθώς και αδιαφοροποίητα καρκινώματα.ref name="Harrison" />
Μετάσταση[επεξεργασία κώδικα]
| Ιστολογικός τύπος | Ανοσοχρώση |
|---|---|
| Καρκίνωμα πλακώδους επιθηλίου (ή ακανθοκυτταρικό καρκίνωμα) | CK5/6 θετική CK7 αρνητική |
| Αδενοκαρκίνωμα | CK7 θετική TTF-1 θετική |
| Mεγαλοκυτταρικό καρκίνωμα | TTF-1 αρνητική |
| Μικροκυτταρικό καρκίνωμα | TTF-1 θετική CD56 θετική χρωμογρανίνη θετική συναπτοφυσίνη θετική |
Ο πνεύμονας αποτελεί συχνή εστία μετάστασης όγκων από άλλα μέρη του σώματος. Οι δευτεροπαθείς καρκίνοι ταξινομούνται βάσει της τοποθεσίας και της προέλευσής τους, π.χ. ο καρκίνος του μαστού που έχει μετασταθεί στον πνεύμονα καλείται μεταστατικός καρκίνος του μαστού. Οι μεταστατικοί όγκοι σε ακτινογραφία θώρακος έχουν συχνά μια χαρακτηριστική στρόγγυλη όψη.[47]
Οι πρωτοπαθείς καρκίνοι του πνεύμονα μεθίστανται συνήθως στον εγκέφαλο, στα οστά, στο ήπαρ και στα επινεφρίδια.[8] Η ανοσοχρώση μιας βιοψίας μπορεί συχνά να αποδειχθεί χρήσιμη προκειμένου να προσδιοριστεί η αρχική προέλευση.[48]
Σταδιοποίηση[επεξεργασία κώδικα]
Η σταδιοποίηση του καρκίνου του πνεύμονα αποτελεί τρόπο αξιολόγησης του βαθμού εξάπλωσής του από το αρχικό σημείο. Αποτελεί έναν από τους παράγοντες που επηρεάζουν την πρόγνωση της ασθένειας και την πιθανή θεραπεία.[1]
Η αρχική εκτίμηση του μικροκυτταρικού καρκινώματος του πνεύμονα (NSCLC) βασίζεται στο σύστημα ταξινόμησης κατά ΤΝΜ. Το σύστημα αυτό βασίζεται στο μέγεθος του πρωτοπαθούς όγκου (tumor), την προσβολή των λεμφαδένων (lymph node) και την ύπαρξη απομακρυσμένων μεταστάσεων (metastasis). Εφόσον γίνει η ταξινόμηση βάσει των παραγόντων TNM ακολουθεί καθορισμός του σταδίου που μπορεί να κυμαίνεται από το στάδιο του λανθάνοντος καρκίνου μέχρι και τα στάδια 0, IA, IB, IIA, IIB, IIIA, IIIB και IV. Ο προσδιορισμός αυτός βοηθά στην επιλογή της θεραπευτικής αγωγής καθώς και στην εκτίμηση της πρόγνωσης.[49] Το μικροκυτταρικό καρκίνωμα του πνεύμονα (SCLC) διακρίνεται συνήθως σε «περιορισμένο στάδιο» (περιορίζεται στη μία πλευρά του θώρακα και μπορεί να περιληφθεί σε ένα μόνο ανεκτό ακτινοθεραπευτικό πεδίο) ή σε «εκτεταμένο στάδιο» (μεγαλύτερος βαθμός εξάπλωσης της νόσου).[1] Ωστόσο, η ταξινόμηση κατά TNM, όπως και ο καθορισμός του σταδίου, συντελούν στην εκτίμηση της πρόγνωσης.[49]
Τόσο για το μη μικροκυτταρικό καρκίνωμα όσο και για το μικροκυτταρικό καρκίνωμα του πνεύμονα χρησιμοποιούνται δύο γενικοί τρόποι σταδιεκτίμησης: η κλινική σταδιοποίηση και η χειρουργική σταδιοποίηση. Η κλινική σταδιοποίηση εφαρμόζεται πριν την οριστική χειρουργική επέμβαση. Βασίζεται στα στοιχεία που προκύπτουν από τις απεικονιστικές εξετάσεις (όπως την αξονική υπολογιστική τομογραφία και την απεικόνιση PET) και στα αποτελέσματα της βιοψίας. Εκτίμηση της χειρουργικής σταδιοποίησης γίνεται είτε κατά τη διάρκεια της χειρουργικής επέμβασης είτε μετά από αυτήν και στηρίζεται στο συνδυασμό των χειρουργικών και κλινικών ευρημάτων, συμπεριλαμβανομένης της χειρουργικής δειγματοληψίας των θωρακικών λεμφαδένων.[8]
Πρόληψη[επεξεργασία κώδικα]
Η πρόληψη είναι το πιο αποδοτικό μέσο για τη μείωση εμφάνισης καρκίνου του πνεύμονα. Ενώ στις περισσότερες χώρες οι καρκινογόνες ουσίες στον εξωτερικό και τον εσωτερικό χώρο έχουν εντοπιστεί και απαγορευθεί, το κάπνισμα εξακολουθεί να είναι ευρέως διαδεδομένο. Η εξάλειψη του καπνίσματος είναι πρωταρχικός στόχος για την πρόληψη του καρκίνου του πνεύμονα και η διακοπή του καπνίσματος αποτελεί σημαντικό προληπτικό μέσο σε αυτήν τη διαδικασία.[50]
Οι πολιτικές παρεμβάσεις για τη μείωση του παθητικού καπνίσματος σε δημόσιους χώρους, όπως στα εστιατόρια και στους χώρους εργασίας έχουν γίνει πιο συχνές σε πολλές δυτικές χώρες.[51] Στο Μπουτάν η πλήρη απαγόρευση του καπνίσματος ισχύει από το 2005,[52] ενώ η Ινδία εισήγαγε την απαγόρευση σε δημόσιους χώρους τον Οκτώβρη του 2008.[53] Ο Παγκόσμιος Οργανισμός Υγείας κάλεσε τις κυβερνήσεις να θεσπίσουν πλήρη απαγόρευση της διαφήμισης προϊόντων καπνού με σκοπό να αποτρέψει τους νέους να ξεκινήσουν το κάπνισμα. Εκτιμάται ότι στις χώρες όπου επιβλήθηκαν αυτού του είδους οι απαγορεύσεις μειώθηκε η κατανάλωση του καπνού κατά 16%.[54]
Η μακροχρόνια χρήση συμπληρωμάτων βιταμίνης A,[55][56] βιταμίνης C,[55] βιταμίνης D[57] ή βιταμίνης E[55] δεν μειώνει τον κίνδυνο καρκίνου του πνεύμονα. Σύμφωνα με ορισμένες μελέτες, όσοι ακολουθούν διατροφή πλουσιότερη σε λαχανικά και φρούτα τείνουν να αντιμετωπίζουν χαμηλότερο κίνδυνο,[20][58] αν και το συμπέρασμα αυτό μάλλον οφείλεται σε στατιστική σύγχυση. Πιο επισταμένες μελέτες δεν έχουν δείξει τέτοια σαφή συσχέτιση.[58]
Διαλογή[επεξεργασία κώδικα]
H διαλογή ή προσυμπτωματικός έλεγχοςείναι η χρήση ιατρικών τεστ για την ανίχνευση της νόσου σε ασυμπτωματικά άτομα. Στα τεστ διαλογής που μπορούν να πραγματοποιηθούν για τον καρκίνο του πνεύμονα περιλαμβάνονται η κυτταρολογική πτυέλων, η ακτινογραφία θώρακος (CXR) και η αξονική τομογραφία (CT). Τα προγράμματα διαλογής με τη χρήση CXR ή κυτταρολογικών εξετάσεων δεν έχουν επιδείξει οφέλη.[59] Η διαλογή όσων διατρέχουν υψηλό κίνδυνο (καπνιστές ηλικίας 55 έως 79 με πάνω από 30 πακέτα/ έτη ή άτομα με καρκίνο του πνεύμονα στο παρελθόν) με αξονική τομογραφία χαμηλής δόσης ακτινοβολίας μπορεί να μειώσει τις πιθανότητες θανάτου από καρκίνο του πνεύμονα κατά απόλυτο ποσοστό 0,3% (και κατά σχετικό ποσοστό 20%).[60][61] Υψηλό είναι, ωστόσο, το ποσοστό των ψευδώς θετικών αποτελεσμάτων, τα οποία μπορεί να συνεπάγονται μη αναγκαίες επεμβάσεις καθώς και σημαντική οικονομική επιβάρυνση.[62] Σε κάθε αληθώς θετικό αποτέλεσμα αντιστοιχούν περισσότερα από 19 ψευδώς θετικά αποτελέσματα.[63] Στις δυνητικές επιπτώσεις της διαλογής συγκαταλέγεται και η έκθεση στην ακτινοβολία.[64]
Αντιμετώπιση[επεξεργασία κώδικα]
Η θεραπευτική αγωγή για τον καρκίνο του πνεύμονα εξαρτάται από τον ακριβή τύπο των καρκινικών κυττάρων, το βαθμό εξάπλωσής του και τη γενική κατάσταση του ασθενούς. Στις συνήθεις θεραπείες περιλαμβάνονται η ανακουφιστική φροντίδα,[65] η χειρουργική επέμβαση, η χημειοθεραπεία και η ακτινοθεραπεία.[1]
Χειρουργική επέμβαση[επεξεργασία κώδικα]
Δείγμα

Εάν οι εξετάσεις επιβεβαιώνουν την ύπαρξη μη μικροκυτταρικού καρκίνου του πνεύμονα (NSCLC), ακολουθεί η εκτίμηση του σταδίου για να προσδιοριστεί αν η βλάβη είναι εντοπισμένη και επιδέχεται χειρουργική επέμβαση ή αν έχει εξαπλωθεί σε τέτοιο βαθμό ώστε να μην αντιμετωπίζεται χειρουργικά. Για το σκοπό αυτό χρησιμοποιούνται η αξονική τομογραφία και η τομογραφία εκπομπής ποζιτρονίων.[1] Εάν υπάρχει υποψία προσβολής των μεσοθωρακικών λεμφαδένων, μπορεί να χρησιμοποιηθεί μεσοθωρακοσκόπηση για τη λήψη λεμφαδενικού δείγματος και για την υποστήριξη της σταδιοποίησης.[66] Οι εξετάσεις αίματοςκαι τα τεστ πνευμονικής λειτουργίας χρησιμοποιούνται για να εκτιμηθεί αν ο ασθενής είναι σε αρκετά καλή κατάσταση για να υποβληθεί σε επέμβαση.[10] Εάν τα τεστ πνευμονικής λειτουργίας δείξουν μικρό εφεδρικό αναπνευστικό όγκο, η χειρουργική επέμβαση ενδέχεται να μην αποτελεί δυνατή λύση.[1]
Στις περισσότερες περιπτώσεις του πρώιμου NSCLC, η θεραπεία που επιλέγεται είναι η χειρουργική αφαίρεση ενός λοβού του πνεύμονα (λοβεκτομή). Σε ασθενείς που δεν είναι κατάλληλοι για πλήρη λοβεκτομή, είναι δυνατή η εκτομή μικρότερου τμήματος του λοβού (σφηνοειδής εκτομή). Ωστόσο, η σφηνοειδής εκτομή ενέχει υψηλότερο κίνδυνο υποτροπής απ' ό,τι η λοβεκτομή.[67] Η βραχυθεραπεία με ραδιενεργό ιώδιο στο περιθώριο της σφηνοειδούς εκτομής μπορεί να μειώσει τον κίνδυνο υποτροπής.[68]Σπάνιες είναι οι περιπτώσεις όπου πραγματοποιείται ολική αφαίρεση πνεύμονα (πνευμονεκτομή).[67] Η βίντεο-υποβοηθούμενη θωρακοσκοπική χειρουργική (VATS) και η λοβεκτομή VATS είναι τεχνικές που υιοθετούν μια ελάχιστα επεμβατική προσέγγιση για τη χειρουργική αντιμετώπιση του καρκίνου του πνεύμονα.[69] Η VATS λοβεκτομή είναι εξίσου αποτελεσματική με εκείνη της συμβατικής ανοιχτής θωρακοτομής, με λιγότερες μετεγχειρητικές επιπλοκές.[70]
Για το μικροκυτταρικό καρκίνο του πνεύμονα (SCLC) χρησιμοποιούνται συνήθως η χημειοθεραπεία ή/και η ακτινοθεραπεία.[71] Σήμερα, ωστόσο, επανεκτιμάται ο ρόλος της χειρουργικής παρέμβασης για τον SCLC. Στην περίπτωση του SCLC σε πρώιμο στάδιο, η χειρουργική επέμβαση θα μπορούσε να βελτιώσει τα αποτελέσματα σε συνδυασμό με χημειοθεραπεία και ακτινοθεραπεία.[72]
Ακτινοθεραπεία[επεξεργασία κώδικα]
Η ακτινοθεραπεία χορηγείται συνήθως σε συνδυασμό με χημειοθεραπεία και μπορεί να χρησιμοποιηθεί για θεραπευτικούς σκοπούς σε ασθενείς με NSCLC που κρίνονται ακατάλληλοι για χειρουργείο. Αυτή η μορφή θεραπείας με υψηλή δόση ακτινοβολίας ονομάζεται ριζική ακτινοθεραπεία.[73] Μια εξέλιξη αυτής της τεχνικής είναι και η συνεχής υπερκλασματοποιημένη ακτινοθεραπεία (CHART), κατά την οποία χορηγείται υψηλή δόση ακτινοβολίας για μικρό χρονικό διάστημα.[74] Η μετεγχειρητική ακτινοθεραπεία στη θωρακική περιοχή θα πρέπει γενικά να αποφεύγεται μετά από χειρουργική επέμβαση που πραγματοποιείται με πρόθεση ίασης του NSCLC.[75] Η μετεγχειρητική ακτινοθεραπεία θα μπορούσε να ωφελήσει ορισμένους ασθενείς με μετάσταση N2 στους μεσοθωρακικούς λεμφαδένες.[76]
Για δυνητικά ιάσιμα περιστατικά SCLC συνιστάται συχνά η ακτινοθεραπεία σε συνδυασμό με τη χημειοθεραπεία.[8]
Εάν η ανάπτυξη του καρκίνου αποφράσσει ένα μικρό τμήμα του βρόγχου, μπορεί να χορηγηθεί βραχυθεραπεία (εντοπισμένη ακτινοθεραπεία) απευθείας στο εσωτερικό του αεραγωγού για τη διάνοιξη της διόδου.[77]Σε σύγκριση με την ακτινοθεραπεία εξωτερικής δέσμης, η βραχυθεραπεία επιτρέπει τη μείωση του χρόνου της θεραπευτικής αγωγής και της έκθεσης του προσωπικού υγειονομικής περίθαλψης στην ακτινοβολία.[78]
Η προφυλακτική κρανιακή ακτινοβολία (PCI) αποτελεί τύπο ακτινοθεραπείας στον εγκέφαλο, ο οποίος χρησιμοποιείται για τη μείωση του κινδύνου μετάστασης. Η PCI είναι χρησιμότερη στην περίπτωση του καρκίνου SCLC. Όταν η νόσος βρίσκεται σε περιορισμένο στάδιο, η PCI αυξάνει την τριετή επιβίωση από το 15% στο 20%. Σε προχωρημένο στάδιο, η μονοετής επιβίωση αυξάνεται από το 13% στο 27%.[79]
Οι πρόσφατες εξελίξεις στους τομείς της στόχευσης και της απεικόνισης έχουν οδηγήσει στην ανάπτυξη της στερεοτακτικής ακτινοθεραπείας για την αντιμετώπιση του καρκίνου του πνεύμονα πρώιμου σταδίου. Σε αυτήν τη μορφή ακτινοθεραπείας χορηγούνται υψηλές δόσεις μέσα σε λίγες συνεδρίες με τη χρήση τεχνικών στερεοτακτικής στόχευσης. Χρησιμοποιείται πρωτίστως σε ασθενείς που είναι ακατάλληλοι για χειρουργείο λόγω ιατρικής συννοσηρότητας.[80]
Τόσο στους ασθενείς με NSCLC όσο και σε εκείνους με SCLC, μπορεί να επιστρατεύεται ακτινοβολία μικρών δόσεων στον θώρακα για τον έλεγχο των συμπτωμάτων (ανακουφιστική ακτινοθεραπεία).[81]
Χημειοθεραπεία[επεξεργασία κώδικα]
Η χημειοθεραπευτική αγωγή εξαρτάται από τον τύπο του όγκου.[8] Ο μικροκυτταρικός καρκίνος του πνεύμονα (SCLC), από τα σχετικά πρώιμα στάδια της νόσου ακόμα, αντιμετωπίζεται πρωταρχικά με χημειοθεραπεία και ακτινοβολία.[82] Συνηθέστερη στον SCLC είναι η χρήση σισπλατίνης και ετοποσίδης.[83] Χρησιμοποιούνται επίσης συνδυαστικά σχήματα με καρβοπλατίνη, γεμσιταβίνη,πακλιταξέλη, βινορελβίνη, τοποτεκάνη και ιρινοτεκάνη.[84][85] Στον προχωρημένο μη μικροκυτταρικό καρκίνο του πνεύμονα (NSCLC), η χημειοθεραπεία αυξάνει την επιβίωση και χρησιμοποιείται ως θεραπευτική αγωγή πρώτης γραμμής, με την προϋπόθεση ότι το άτομο είναι σε καλή γενική κατάσταση για να δεχθεί τη θεραπεία.[86] Κατά κανόνα χρησιμοποιούνται δυο φαρμακευτικές ουσίες, μία από τις οποίες έχει συχνά ως βάση την πλατίνα (είτε σισπλατίνη είτε καρβοπλατίνη). Άλλες φαρμακευτικές ουσίες που συνήθως χρησιμοποιούνται είναι η γεμσιταβίνη, η πακλιταξέλη, η δοσεταξέλη,[87][88] η πεμετρεξέδη,[89] η ετοποσίδη και η βινορελβίνη.[88]
Η επικουρική χημειοθεραπεία αφορά την χρήση χημειοθεραπείας ύστερα από εμφανώς θεραπευτική χειρουργική επέμβαση με σκοπό τη βελτίωση του αποτελέσματος. Στον μη μικροκυτταρικό καρκίνο του πνεύμονα (ΜΜΚΠ), λαμβάνονται δείγματα από κοντινούς λεμφαδένες κατά τη διάρκεια της επέμβασης για να διευκολυνθεί η σταδιοποίηση. Αν επιβεβαιωθεί καρκίνος σε στάδιο II ή III, η επικουρική χημειοθεραπεία βελτιώνει την επιβίωση κατά 5% στα πέντε χρόνια.[90][91]Ο συνδυασμός βινορελμπίνης και σισπλατίνης είναι πιο αποτελεσματικός σε σύγκριση με παλαιότερες αγωγές.[91] Η επικουρική χημειοθεραπεία σε ασθενείς με καρκίνο στο στάδιο IB είναι αμφιλεγόμενη, καθώς οι κλινικές δοκιμές δεν έχουν καταδείξει ξεκάθαρα οφέλη ως προς την επέκταση της ζωής.[92][93] Δοκιμές της προεγχειρητικής χημειοθεραπείας (προεγχειρητική χημειοθεραπεία) σε αφαιρέσιμο ΜΜΚΠ δεν έχουν καταλήξει σε οριστικά συμπεράσματα.[94]
Ανακουφιστική φροντίδα[επεξεργασία κώδικα]
Στους ασθενείς που βρίσκονται σε καταληκτικό στάδιο, μπορεί να ενδείκνυται η κατ’ οίκον νοσηλεία και ανακουφιστική φροντίδα.[10] Αυτή η προσέγγιση επιτρέπει την περαιτέρω εξέταση των διαθέσιμων επιλογών θεραπείας και παρέχει την ευκαιρία να διαμορφωθούν καλοζυγισμένες αποφάσεις [95][96] για την αποφυγή μη βοηθητικών, δαπανηρών θεραπειών στο καταληκτικό στάδιο της ζωής.[96]
Η χημειοθεραπεία μπορεί να συνδυαστεί με την ανακουφιστική φροντίδα για την αντιμετώπιση του ΜΜΚΠ. Σε προχωρημένες περιπτώσεις, η κατάλληλη χημειοθεραπεία βελτιώνει τον μέσο όρο επιβίωσης καθώς και την ποιότητα ζωής έναντι της παροχής μόνο υποστηρικτικής φροντίδας.[97] Με καλή φυσική κατάσταση, η συνέχιση της χημειοθεραπείας κατά την ανακουφιστική φροντίδα σε ασθενείς με καρκίνο του πνεύμονα επεκτείνει τη ζωή κατά 1,5 με 3 μήνες, ανακουφίζει από τα συμπτώματα και βελτιώνει την ποιότητα της ζωής, ενώ με τις σύγχρονες ουσίες παρατηρούνται καλύτερα αποτελέσματα.[98][99] Η επιστημονική ομάδα NSCLC Meta-Analyses Collaborative Group συστήνει όπως σε περίπτωση που ο ασθενής επιθυμεί και μπορεί να αντέξει την αγωγή να εξετάζεται η χρήση χημειοθεραπείας και όταν ο ΜΜΚΠ βρίσκεται σε προχωρημένο στάδιο.[86][100]
Πρόγνωση[επεξεργασία κώδικα]
| Clinical stage | Five-year survival (%) | |
|---|---|---|
| Non-small cell lung carcinoma | Small cell lung carcinoma | |
| IA | 50 | 38 |
| IB | 47 | 21 |
| IIA | 36 | 38 |
| IIB | 26 | 18 |
| IIIA | 19 | 13 |
| IIIB | 7 | 9 |
| IV | 2 | 1 |
Η πρόγνωση επιβίωσης είναι γενικά χαμηλή. Στο σύνολο των ασθενών με καρκίνο του πνεύμονα, 15% ζουν για πέντε χρόνια μετά τη διάγνωση.[2] Συχνά, η ασθένεια βρίσκεται σε προχωρημένο στάδιο όταν γίνεται η διάγνωση. Όταν παρουσιάζονται οι ασθενείς, 30–40% των περιπτώσεων ΜΜΚΠ είναι στο στάδιο IV, ενώ όσον αφορά τον μικροκυτταρικό καρκίνο του πνεύμονα (ΜΚΠ) το ποσοστό που βρίσκεται στο στάδιο IV ανέρχεται στο 60%.[8]
Οι προγνωστικοί παράγοντες στον ΜΜΚΠ περιλαμβάνουν την παρουσία ή απουσία πνευμονικών συμπτωμάτων, το μέγεθος του όγκου, την (ιστολογία) του τύπου κυττάρου, τον βαθμό εξάπλωσης, τη (στάδιο) και τις μεταστάσεις σε πολλαπλούς λεμφαδένες, καθώς και την αγγειακή διήθηση. Στους ασθενείς που βρίσκονται σε μη εγχειρίσιμη κατάσταση, τα αποτελέσματα είναι χειρότερα σε όσους έχουν χαμηλή κατάσταση απόδοσης και παρουσιάζουν απώλεια βάρους που υπερβαίνει το 10%.[101] Στους προγνωστικούς παράγοντες για τον μικροκυτταρικό καρκίνο του πνεύμονα περιλαμβάνονται η κατάσταση απόδοσης, το φύλο, το στάδιο της ασθένειας, και η συμμετοχή που έχει το κεντρικό νευρικό σύστημα ή το ήπαρ κατά τη διάγνωση.[102]
Όσον αφορά τον ΜΜΚΠ, η καλύτερη πρόγνωση επιβίωσης επιτυγχάνεται με την πλήρη χειρουργική αφαίρεση του καρκινώματος στο στάδιο IA της ασθένειας, με ποσοστό μέχρι 70% να επιβιώνει για πέντε χρόνια.[103] Όσον αφορά τον μικροκυτταρικό καρκίνο του πνεύμονα (ΜΚΠ), το συνολικό ποσοστό των ασθενών που επιβιώνει για πέντε χρόνια είναι περίπου 5%.[1] Το ποσοστό πενταετούς επιβίωσης σε ασθενείς με ΜΚΠ σε προχωρημένο στάδιο είναι κατά μέσο όρο κάτω από 1%. Ο μέσος χρόνος επιβίωσης για μη προχωρημένα στάδια της ασθένειας είναι οι 20 μήνες, με την επιβίωση για πέντε χρόνια να κυμαίνεται στο 20%.[2]
Σύμφωνα με στοιχεία του Εθνικού Ινστιτούτου Καρκίνου των Η.Π.Α., η διάμεση ηλικία κατά τη διάγνωση του καρκίνου του πνεύμονα στις Ηνωμένες Πολιτείες είναι τα 70 χρόνια,[104] και η διάμεση ηλικία κατά τον θάνατο είναι τα 72 χρόνια.[105] Στις Ηνωμένες Πολιτείες, τα άτομα με ιατρική ασφάλιση είναι πιθανότερο να έχουν καλύτερα αποτελέσματα.[106]
Επιδημιολογία[επεξεργασία κώδικα]

no data ≤ 5 5-10 10-15 15-20 20-25 25-30 | 30-35 35-40 40-45 45-50 50-55 ≥ 55 |
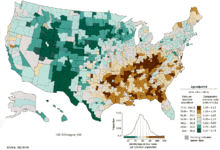
Παγκοσμίως, ο καρκίνος του πνεύμονα είναι ο πιο συνηθισμένος καρκίνος τόσο από άποψη συχνότητας εμφάνισης όσο και θνησιμότητας. Το 2008, καταγράφηκαν 1,61 εκατομμύρια νέες περιπτώσεις και 1,38 εκατομμύρια θάνατοι λόγω καρκίνου του πνεύμονα. Τα ψηλότερα ποσοστά παρουσιάζονται στην Ευρώπη και τη βόρεια Αμερική.[11] Η ομάδα πληθυσμού που είναι πιο πιθανόν να αναπτύξει καρκίνο του πνεύμονα είναι τα άτομα άνω των 50 χρονών που είναι ή υπήρξαν καπνιστές. Σε αντίθεση με τα ποσοστά θνησιμότητας στους άντρες, τα οποία άρχισαν να μειώνονται εδώ και περισσότερα από 20 χρόνια, τα ποσοστά θνησιμότητας στις γυναίκες με καρκίνο του πνεύμονα παρουσιάζουν αύξηση τις τελευταίες δεκαετίες, και μόλις πρόσφατα άρχισαν να σταθεροποιούνται.[108] Στις ΗΠΑ, ο κίνδυνος εφ’όρου ζωής εκδήλωσης καρκίνου του πνεύμονα είναι 8% στους άντρες και 6% στις γυναίκες.[1]
Για κάθε 3–4 εκατομμύρια τσιγάρα που καπνίζονται, καταγράφεται ένας θάνατος από καρκίνο του πνεύμονα.[1][109] Η επίδραση των μεγάλων καπνοβιομηχανιών γνωστών και ως "Big Tobacco" παίζει σημαντικό ρόλο στην κουλτούρα του καπνίσματος.[110] Οι νεαροί μη καπνιστές που παρακολουθούν διαφημίσεις είναι πιο πιθανόν ν’ αρχίσουν το κάπνισμα.[111] Το παθητικό κάπνισμα ολοένα και περισσότερο αναγνωρίζεται ως παράγοντας κινδύνου για τον καρκίνο του πνεύμονα,[24] οδηγώντας σε πολιτικές παρεμβάσεις για τη μείωση της ανεπιθύμητης έκθεσης των μη καπνιστών στον καπνό από τα τσιγάρα των άλλων.[112] Οι εκπομπές ρύπων από αυτοκίνητα, εργοστάσια και ηλεκτροπαραγωγικούς σταθμούς αποτελούν επίσης πιθανούς κινδύνους.[4]
Στην ανατολική Ευρώπη καταγράφεται η ψηλότερη θνησιμότητα από καρκίνο του πνεύμονα στους άντρες, ενώ η βόρεια Ευρώπη και οι ΗΠΑ έχουν την ψηλότερη θνησιμότητα στις γυναίκες. Στις Ηνωμένες Πολιτείες, ο καρκίνος του πνεύμονα εμφανίζεται συχνότερα στους έγχρωμους άντρες και γυναίκες.[113] Τα ποσοστά καρκίνου του πνεύμονα είναι επί του παρόντος χαμηλότερα στις αναπτυσσόμενες χώρες.[114] Με την αύξηση του καπνίσματος στις αναπτυσσόμενες χώρες, τα ποσοστά αναμένεται να αυξηθούν μέσα στα επόμενα λίγα χρόνια, ιδίως στην Κίνα [115] και την Ινδία.[116]
Από τη δεκαετία του 1960, τα ποσοστά αδενοκαρκινώματος του πνεύμονα άρχισαν ν’ αυξάνονται σε σχέση με τα ποσοστά καρκίνων άλλου είδους. Αυτό οφείλεται εν μέρει στην εμφάνιση των τσιγάρων με φίλτρο. Η χρήση φίλτρων αφαιρεί τα μεγαλύτερα μόρια του καπνού, μειώνοντας επομένως την απόθεση στους μεγαλύτερους αεραγωγούς. Ωστόσο, ο καπνιστής πρέπει να εισπνέει πιο βαθιά για να λαμβάνει την ίδια ποσότητα νικοτίνης, γεγονός που αυξάνει την απόθεση μορίων στους μικρούς αεραγωγούς όπου τείνει να δημιουργείται το αδενοκαρκίνωμα. [117] Η συχνότητα εμφάνισης του αδενοκαρκινώματος του πνεύμονα εξακολουθεί ν’ αυξάνεται.[118]
Ιστορία[επεξεργασία κώδικα]
Ο καρκίνος του πνέυμονα ήταν ασυνήθιστο φαινόμενο πριν από την έλευση του καπνίσματος — δεν είχε αναγνωριστεί καν ως διακριτή ασθένεια μέχρι το 1761.[119] Διάφορες πτυχές του καρκίνου του πνεύμονα περιγράφηκαν περαιτέρω το 1810.[120]Οι κακοήθεις όγκοι του πνεύμονα αντιστοιχούσαν μόλις στο 1% όλων των καρκίνων που είχαν εντοπιστεί σε αυτοψίες το 1878, αλλά ανήλθαν στο 10–15% μέχρι τις αρχές της δεκαετίας του 1900.[121] Τα καταγεγραμμένα περιστατικά στην ιατρική βιβλιογραφία αριθμούσαν μόλις 374 παγκοσμίως το 1912,[122]αλλά μια αναθεώρηση των αυτοψιών κατέδειξε ότι τα περιστατικά του καρκίνου του πνεύμονα είχαν αυξηθεί από 0,3% το 1852 στο 5,66% το 1952.[123] Στη Γερμανία το 1929, ο γιατρός Fritz Lickint εντόπισε τη διασύνδεση μεταξύ καπνίσματος και καρκίνου του πνεύμονα,[121] γεγονός το οποίο οδήγησε σ’ ένα επιθετικό αντικαπνιστική εκστρατεία.[124] Η Μελέτη Βρετανών Γιατρών, που δημοσιεύθηκε τη δεκαετία του 1950, παρείχε τα πρώτα τεκμηριωμένα επιδημιολογικά στοιχεία για τη σχέση μεταξύ του καρκίνου του πνεύμονα και του καπνίσματος.[125] Ως αποτέλεσμα, το 1964 ο Γενικός Χειρούργος των Ηνωμένων Πολιτειών συστήνει στους καπνιστές να σταματήσουν το κάπνισμα.[126]
Η διασύνδεση με το αέριο ραδόνιο εντοπίστηκε αρχικά στους μεταλλωρύχους στα Όρη Όρε κοντά στο Σνέεμπεργκ, Σαξωνία. Εκεί υπάρχουν ορυχεία για ασήμι από το 1470, τα οποία είναι πλούσια σε ουράνιο, συνοδευόμενο από ράδιο και αέριο ραδόνιο.[127] Οι μεταλλωρύχοι ανέπτυσσαν σε δυσανάλογα ποσοστά παθήσεις του πνεύμονα, οι οποίες τελικά αναγνωρίστηκαν ως καρκίνος του πνεύμονα τη δεκαετία του 1870.[128] Παρά την ανακάλυψη αυτή, οι μεταλλευτικές εργασίες συνεχίστηκαν μέχρι και τη δεκαετία του 1950, λόγω των αναγκών της ΕΣΣΔ σε ουράνιο.[127] Το ραδόνιο επιβεβαιώθηκε ως αιτία καρκίνου του πνεύμονα τη δεκαετία του 1960.[129]
Η πρώτη επιτυχής πνευμονεκτομή για καρκίνο του πνεύμονα πραγματοποιήθηκε το 1933.[130] Η ανακουφιστική ακτινοθεραπεία χρησιμοποιείται από τη δεκαετία του 1940.[131] Η ριζική ακτινοθεραπεία, η οποία χρησιμοποιήθηκε αρχικά τη δεκαετία του 1950, ήταν μια απόπειρα χρήσης μεγαλύτερων δόσεων ακτινοβολίας σε καρκινοπαθείς που βρίσκονταν στο αρχικό στάδιο της ασθένειας αλλά δεν ήταν κατάλληλοι για χειρουργική επέμβαση.[132] Το 1997, η συνεχής υπερκλασματοποιημένη επιταχυνόμενη ακτινοθεραπεία (CHART) θεωρήθηκε ως πιο εξελιγμένη μέθοδος σε σύγκριση με τη συμβατική ριζική ακτινοθεραπεία.[133] Όσον αφορά τον μικροκυτταρικό καρκίνο του πνεύμονα, οι αρχικές απόπειρες τη δεκαετία του 1960 για χειρουργική αφαίρεση [134] και ριζική ακτινοθεραπεία[135] ήταν ανεπιτυχείς. Τη δεκαετία του 1970, αναπτύχθηκαν επιτυχή προγράμματα χημειοθεραπείας.[136]
Παραπομπές[επεξεργασία κώδικα]
- ↑ 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 1,10 1,11 1,12 1,13 1,14 1,15 1,16 1,17 1,18 Horn, L (2012). «Chapter 89». Στο: Longo, DL· Kasper, DL· Jameson, JL· Fauci, AS· Hauser, SL· Loscalzo, J. Harrison's Principles of Internal Medicine (18th έκδοση). McGraw-Hill. ISBN 0-07-174889-X. Unknown parameter
|coauthors=ignored (|author=suggested) (βοήθεια) - ↑ 2,0 2,1 2,2 2,3 «Lung Carcinoma: Tumors of the Lungs». Merck Manual Professional Edition, Online edition. Ανακτήθηκε στις 15 Αυγούστου 2007.
- ↑ Thun, MJ; Hannan LM, Adams-Campbell LL et al. (September 2008). «Lung cancer occurrence in never-smokers: an analysis of 13 cohorts and 22 cancer registry studies». PLoS Medicine 5 (9): e185. doi:. PMID 18788891.
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 4,6 4,7 Alberg AJ, Samet JM (2010). «Chapter 46». Murray & Nadel's Textbook of Respiratory Medicine (5th έκδοση). Saunders Elsevier. ISBN 978-1-4160-4710-0.
- ↑ 5,0 5,1 O'Reilly, KM; Mclaughlin AM, Beckett WS, Sime PJ (March 2007). «Asbestos-related lung disease». American Family Physician 75 (5): 683–688. PMID 17375514. http://www.aafp.org/afp/20070301/683.html.
- ↑ Carmona, RH (27 Ιουνίου 2006). «The Health Consequences of Involuntary Exposure to Tobacco Smoke: A Report of the Surgeon General». U.S. Department of Health and Human Services.
Secondhand smoke exposure causes disease and premature death in children and adults who do not smoke.
- ↑ «Tobacco Smoke and Involuntary Smoking» (PDF). IARC Monographs on the Evaluation of Carcinogenic Risks to Humans (WHO International Agency for Research on Cancer) 83. 2002. http://monographs.iarc.fr/ENG/Monographs/vol83/volume83.pdf. «There is sufficient evidence that involuntary smoking (exposure to secondhand or 'environmental' tobacco smoke) causes lung cancer in humans. ... Involuntary smoking (exposure to secondhand or 'environmental' tobacco smoke) is carcinogenic to humans (Group 1).».
- ↑ 8,00 8,01 8,02 8,03 8,04 8,05 8,06 8,07 8,08 8,09 8,10 Lu, C (2010). «78: Cancer of the Lung». Holland-Frei Cancer Medicine (8th έκδοση). People's Medical Publishing House. ISBN 9781607950141. Unknown parameter
|coauthors=ignored (|author=suggested) (βοήθεια) - ↑ Chapman, S (2009). «Chapter 31». Oxford Handbook of Respiratory Medicine (2nd έκδοση). Oxford University Press. ISBN 9-780199-545162. Unknown parameter
|coauthors=ignored (|author=suggested) (βοήθεια) - ↑ 10,0 10,1 10,2 10,3 10,4 10,5 Collins, LG; Haines C, Perkel R, Enck RE (January 2007). «Lung cancer: diagnosis and management». American Family Physician (American Academy of Family Physicians) 75 (1): 56–63. PMID 17225705. http://www.aafp.org/afp/20070101/56.html.
- ↑ 11,0 11,1 Ferlay, J; Shin HR, Bray F et al. (December 2010). «Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008». International Journal of Cancer 127 (12): 2893–2917. doi:. PMID 21351269. http://onlinelibrary.wiley.com/doi/10.1002/ijc.25516/full.
- ↑ Honnorat, J; Antoine JC (May 2007). «Paraneoplastic neurological syndromes». Orphanet Journal of Rare Diseases (BioMed Central) 2 (1): 22. doi:. PMID 17480225. PMC 1868710. http://www.ojrd.com/content/2/1/22.
- ↑ Greene, Frederick L. (2002). AJCC cancer staging manual. Berlin: Springer-Verlag. ISBN 0-387-95271-3.
- ↑ Brown, KM (2010). «8». Holland-Frei Cancer Medicine (8th έκδοση). People's Medical Publishing House USA. ISBN 978-1607950141. Unknown parameter
|coauthors=ignored (|author=suggested) (βοήθεια) - ↑ Biesalski, HK; Bueno de Mesquita B, Chesson A et al. (1998). «European Consensus Statement on Lung Cancer: risk factors and prevention. Lung Cancer Panel». CA Cancer J Clin (Smoking is the major risk factor, accounting for about 90% of lung cancer incidence.) 48 (3): 167–176; discussion 164–166. doi:. PMID 9594919.
- ↑ Hecht, S (October 2003). «Tobacco carcinogens, their biomarkers and tobacco-induced cancer». Nature Reviews Cancer (Nature Publishing Group) 3 (10): 733–744. doi:. PMID 14570033. http://www.nature.com/nrc/journal/v3/n10/abs/nrc1190_fs.html.
- ↑ Sopori, M (May 2002). «Effects of cigarette smoke on the immune system». Nature Reviews Immunology 2 (5): 372–7. doi:. PMID 12033743.
- ↑ Peto, R (2006). Mortality from smoking in developed countries 1950–2000: Indirect estimates from National Vital Statistics. Oxford University Press. ISBN 0-19-262535-7. Unknown parameter
|coauthors=ignored (|author=suggested) (βοήθεια) - ↑ California Environmental Protection Agency (1997). «Health effects of exposure to environmental tobacco smoke. California Environmental Protection Agency». Tobacco Control 6 (4): 346–353. doi:. PMID 9583639. PMC 1759599. http://www.druglibrary.org/schaffer/tobacco/caets/ets-main.htm.
* CDC (December 2001). «State-specific prevalence of current cigarette smoking among adults, and policies and attitudes about secondhand smoke—United States, 2000». Morbidity and Mortality Weekly Report (Atlanta, Georgia: CDC) 50 (49): 1101–1106. PMID 11794619. http://www.cdc.gov/mmwr/preview/mmwrhtml/mm5049a1.htm. - ↑ 20,0 20,1 20,2 20,3 Alberg, AJ; Samet JM (September 2007). «Epidemiology of lung cancer». Chest (American College of Chest Physicians) 132 (S3): 29S–55S. doi:. PMID 17873159. http://chestjournal.chestpubs.org/content/132/3_suppl/29S.long.
- ↑ Jaakkola, MS; Jaakkola JJ (August 2006). «Impact of smoke-free workplace legislation on exposures and health: possibilities for prevention». European Respiratory Journal 28 (2): 397–408. doi:. PMID 16880370. http://erj.ersjournals.com/content/28/2/397.long.
- ↑ Parkin, DM (December 2011). «Tobacco—attributable cancer burden in the UK in 2010». British Journal of Cancer 105 (Suppl. 2): S6–S13. doi:. PMID 22158323. PMC 3252064. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3252064/?tool=pubmed.
- ↑ National Health and Medical Research Council (April 1994). The health effects and regulation of passive smoking. Australian Government Publishing Service. Αρχειοθετήθηκε από το πρωτότυπο στις September 29, 2007. https://web.archive.org/web/20070929025344/http://www.obpr.gov.au/publications/submission/healthef/index.html. Ανακτήθηκε στις 2007-08-10.
- ↑ 24,0 24,1 Taylor, R; Najafi F, Dobson A (October 2007). «Meta-analysis of studies of passive smoking and lung cancer: effects of study type and continent». International Journal of Epidemiology 36 (5): 1048–1059. doi:. PMID 17690135. http://ije.oxfordjournals.org/content/36/5/1048.long.
- ↑ «Frequently asked questions about second hand smoke». World Health Organization. Ανακτήθηκε στις 25 Ιουλίου 2012.
- ↑ Schick, S; Glantz S (December 2005). «Philip Morris toxicological experiments with fresh sidestream smoke: more toxic than mainstream smoke». Tobacco Control 14 (6): 396–404. doi:. PMID 16319363.
- ↑ Schmid K, Kuwert T, Drexler H (March 2010). «Radon in Indoor Spaces: An Underestimated Risk Factor for Lung Cancer in Environmental Medicine». Dtsch Arztebl Int 107 (11): 181–6. doi:. PMID 20386676.
- ↑ EPA (Οκτωβρίου 2006). «Radiation information: radon». EPA. Ανακτήθηκε στις 11 Αυγούστου 2007.
- ↑ Davies, RJO (2010). «18.19.3». Oxford Textbook Medicine (5th έκδοση). OUP Oxford. ISBN 978-0199204854. Unknown parameter
|coauthors=ignored (|author=suggested) (βοήθεια) - ↑ Chen, H; Goldberg MS, Villeneuve PJ (Oct-Dec 2008). «A systematic review of the relation between long-term exposure to ambient air pollution and chronic diseases». Reviews on Environmental Health 23 (4): 243–297. PMID 19235364.
- ↑ 31,0 31,1 Lim, WY; Seow, A (2012 Jan). «Biomass fuels and lung cancer.». Respirology (Carlton, Vic.) 17 (1): 20-31. PMID 22008241.
- ↑ 32,0 32,1 Sood, A (2012 Dec). «Indoor fuel exposure and the lung in both developing and developed countries: an update.». Clinics in chest medicine 33 (4): 649-65. PMID 23153607.
- ↑ Dudley, Joel (2013). Exploring Personal Genomics. Oxford University Press. σελ. 25. ISBN 9780199644483.
- ↑ Kern JA, McLennan G (2008). Fishman's Pulmonary Diseases and Disorders (4th έκδοση). McGraw-Hill. σελ. 1802. ISBN 0-07-145739-9.
- ↑ Cogliano, VJ; Baan, R; Straif, K; Grosse, Y; Lauby-Secretan, B; El Ghissassi, F; Bouvard, V; Benbrahim-Tallaa, L; Guha, N; Freeman, C; Galichet, L; Wild, CP (2011 Dec 21). «Preventable exposures associated with human cancers.». Journal of the National Cancer Institute 103 (24): 1827-39. PMID 22158127. http://monographs.iarc.fr/ENG/Classification/Table4.pdf.
- ↑ Fong, KM; Sekido Y, Gazdar AF, Minna JD (October 2003). «Lung cancer • 9: Molecular biology of lung cancer: clinical implications». Thorax (BMJ Publishing Group Ltd.) 58 (10): 892–900. doi:. PMID 14514947.
- ↑ Salgia, R; Skarin AT (March 1998). «Molecular abnormalities in lung cancer». Journal of Clinical Oncology 16 (3): 1207–1217. PMID 9508209.
- ↑ 38,0 38,1 38,2 38,3 Herbst, RS; Heymach JV, Lippman SM (September 2008). «Lung cancer». New England Journal of Medicine 359 (13): 1367–1380. doi:. PMID 18815398. http://content.nejm.org/cgi/content/full/359/13/1367.
- ↑ Aviel-Ronen, S; Blackhall FH, Shepherd FA, Tsao MS (July 2006). «K-ras mutations in non-small-cell lung carcinoma: a review». Clinical Lung Cancer (Cancer Information Group) 8 (1): 30–38. doi:. PMID 16870043.
- ↑ Devereux, TR; Taylor JA, Barrett JC (March 1996). «Molecular mechanisms of lung cancer. Interaction of environmental and genetic factors». Chest (American College of Chest Physicians) 109 (Suppl 3): 14S–19S. doi:. PMID 8598134.
- ↑ Miller, WT (2008). Fishman's Pulmonary Diseases and Disorders (4th έκδοση). McGraw-Hill. σελ. 486. ISBN 0-07-145739-9.
- ↑ Kaiser, LR (2008). Fishman's Pulmonary Diseases and Disorders (4th έκδοση). McGraw-Hill. σελίδες 1815–1816. ISBN 0-07-145739-9.
- ↑ 43,0 43,1 Maitra, A (2007). Robbins Basic Pathology (8th έκδοση). Saunders Elsevier. σελίδες 528–529. ISBN 978-1-4160-2973-1. Unknown parameter
|coauthors=ignored (|author=suggested) (βοήθεια) - ↑ Subramanian, J; Govindan R (February 2007). «Lung cancer in never smokers: a review». Journal of Clinical Oncology (American Society of Clinical Oncology) 25 (5): 561–570. doi:. PMID 17290066.
- ↑ Raz, DJ; He B, Rosell R, Jablons DM (March 2006). «Bronchioloalveolar carcinoma: a review». Clinical Lung Cancer 7 (5): 313–322. doi:. PMID 16640802.
- ↑ Rosti, G; Bevilacqua G, Bidoli P et al. (March 2006). «Small cell lung cancer». Annals of Oncology 17 (Suppl. 2): 5–10. doi:. PMID 16608983.
- ↑ Seo, JB; Im JG, Goo JM et al. (1 March 2001). «Atypical pulmonary metastases: spectrum of radiologic findings». Radiographics 21 (2): 403–417. PMID 11259704. http://radiographics.rsnajnls.org/cgi/content/full/21/2/403.
- ↑ Tan D, Zander DS (2008). «Immunohistochemistry for Assessment of Pulmonary and Pleural Neoplasms: A Review and Update». Int J Clin Exp Pathol 1 (1): 19–31. PMID 18784820.
- ↑ 49,0 49,1 49,2 Rami-Porta, R; Crowley JJ, Goldstraw P (February 2009). «The revised TNM staging system for lung cancer». Annals of Thoracic and Cardiovascular Surgery 15 (1): 4–9. PMID 19262443. http://www.atcs.jp/pdf/2009_15_1/4.pdf.
- ↑ Goodman, GE (November 2002). «Lung cancer. 1: prevention of lung cancer». Thorax 57 (11): 994–999. PMID 12403886. PMC 1746232. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1746232/pdf/v057p00994.pdf.
- ↑ McNabola, A; Gill LW (February 2009). «The control of environmental tobacco smoke: a policy review». International Journal of Environmental Research and Public Health 6 (2): 741–758. doi:. PMID 19440413.
- ↑ Pandey, G (February 2005). «Bhutan's smokers face public ban». BBC. http://news.bbc.co.uk/2/hi/south_asia/4305715.stm. Ανακτήθηκε στις 2007-09-07.
- ↑ Pandey, G (2 October 2008). «Indian ban on smoking in public». BBC. http://news.bbc.co.uk/1/hi/world/south_asia/7645868.stm. Ανακτήθηκε στις 2012-04-25.
- ↑ United Nations News service (30 May 2008). UN health agency calls for total ban on tobacco advertising to protect young. Δελτίο τύπου.
- ↑ 55,0 55,1 55,2 Fabricius, P; Lange P (July–September 2003). «Diet and lung cancer». Monaldi Archives for Chest Disease 59 (3): 207–211. PMID 15065316.
- ↑ Fritz, H; Kennedy D, Fergusson D et al. (2011). «Vitamin A and Retinoid Derivatives for Lung Cancer: A Systematic Review and Meta Analysis». PLoS ONE 6 (6): e21107. doi:. PMID 21738614.
- ↑ Herr, C; Greulich T, Koczulla RA et al. (March 2011). «The role of vitamin D in pulmonary disease: COPD, asthma, infection, and cancer». Respiratory Research 12 (1): 31. doi:. PMID 21418564.
- ↑ 58,0 58,1 Key, TJ (January 2011). «Fruit and vegetables and cancer risk». British Journal of Cancer 104 (1): 6–11. doi:. PMID 21119663.
- ↑ Manser, RL; Irving LB, Stone C et al. (2004). «Screening for lung cancer». Cochrane Database of Systematic Reviews (1): CD001991. doi:. PMID 14973979. http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD001991.pub2/full.
- ↑ Jaklitsch, MT; Jacobson FL, Austin JH et al. (July 2012). «The American Association for Thoracic Surgery guidelines for lung cancer screening using low-dose computed tomography scans for lung cancer survivors and other high-risk groups». Journal of Thoracic and Cardiovascular Surgery 144 (1): 33–38. doi:. PMID 22710039.
- ↑ Bach, PB; Mirkin JN, Oliver TK et al. (June 2012). «Benefits and harms of CT screening for lung cancer:a systematic review». JAMA:the Journal of the American Medical Association 307 (22): 2418–2429. doi:. PMID 22610500.
- ↑ Boiselle, PM (2013 Mar 20). «Computed tomography screening for lung cancer.». JAMA :the journal of the American Medical Association 309 (11): 1163-70. PMID 23512063.
- ↑ Bach PB, Mirkin JN, Oliver TK, et al. (June 2012). «Benefits and harms of CT screening for lung cancer:a systematic review». JAMA 307 (22): 2418–29. doi:. PMID 22610500.
- ↑ Aberle, DR; Abtin, F; Brown, K (2013 Mar 10). «Computed tomography screening for lung cancer:has it finally arrived? Implications of the national lung screening trial.». Journal of clinical oncology : official journal of the American Society of Clinical Oncology 31 (8): 1002-8. PMID 23401434.
- ↑ Ferrell, B; Koczywas M, Grannis F, Harrington A (April 2011). «Palliative care in lung cancer». Surgical Clinics of North America 91 (2): 403–417. doi:. PMID 21419260.
- ↑ Kaiser LR (2008). Fishman's Pulmonary Diseases and Disorders (4th έκδοση). McGraw-Hill. σελίδες 1853–1854. ISBN 0-07-145739-9.
- ↑ 67,0 67,1 Kaiser LR (2008). Fishman's Pulmonary Diseases and Disorders (4th έκδοση). McGraw-Hill. σελίδες 1855–1856. ISBN 0-07-145739-9.
- ↑ Odell, DD; Kent MS, Fernando HC (Spring 2010). «Sublobar resection with brachytherapy mesh for stage I non-small cell lung cancer». Seminars in Thoracic and Cardiovascular Surgery 22 (1): 32–37. doi:. PMID 20813314.
- ↑ Alam, N; Flores RM (July–September 2007). «Video-assisted thoracic surgery (VATS) lobectomy:the evidence base». Journal of the Society of Laparoendoscopic Surgeons 11 (3): 368–374. PMID 17931521.
- ↑ Rueth, NM; Andrade RS (June 2010). «Is VATS lobectomy better:perioperatively, biologically and oncologically?». Annals of Thoracic Surgery 89 (6): S2107–S2111. doi:. PMID 20493991.
- ↑ Simon GR, Turrisi A (September 2007). «Management of small cell lung cancer:ACCP evidence-based clinical practice guidelines (2nd edition)». Chest 132 (3 Suppl): 324S–339S. doi:. PMID 17873178. http://chestjournal.chestpubs.org/content/132/3_suppl/324S.long.
- ↑ Goldstein, SD; Yang SC (October 2011). «Role of surgery in small cell lung cancer». Surgical Oncology Clinics of North America 20 (4): 769–777. doi:. PMID 21986271.
- ↑ Arriagada, R (2002). Oxford Textbook of Oncology (2nd έκδοση). Oxford University Press. σελ. 2094. ISBN 0-19-262926-3. Unknown parameter
|coauthors=ignored (|author=suggested) (βοήθεια) - ↑ Hatton, MQ; Martin JE (June 2010). «Continuous hyperfractionated accelerated radiotherapy (CHART) and non-conventionally fractionated radiotherapy in the treatment of non-small cell lung cancer:a review and consideration of future directions». Clinical Oncology (Royal College of Radiologists) 22 (5): 356–364. doi:. PMID 20399629.
- ↑ PORT Meta-analysis Trialists Group (2005). Rydzewska, Larysa, επιμ. «Postoperative radiotherapy for non-small cell lung cancer». Cochrane Database of Systematic Reviews (2): CD002142. doi:. PMID 15846628.
- ↑ Le Péchoux, C (2011). «Role of postoperative radiotherapy in resected non-small cell lung cancer:a reassessment based on new data». Oncologist 16 (5): 672–681. doi:. PMID 21378080.
- ↑ Cardona, AF; Reveiz L, Ospina EG et al. (April 2008). «Palliative endobronchial brachytherapy for non-small cell lung cancer». Cochrane Database of Systematic Reviews (2): CD004284. doi:. PMID 18425900.
- ↑ Ikushima, H (February 2010). «Radiation therapy:state of the art and the future». Journal of Medical Investigation 57 (1–2): 1–11. PMID 20299738. http://www.jstage.jst.go.jp/article/jmi/57/1,2/1/_pdf.
- ↑ Paumier, A; Cuenca X, Le Péchoux C (June 2011). «Prophylactic cranial irradiation in lung cancer». Cancer Treatment Reviews 37 (4): 261–265. doi:. PMID 20934256.
- ↑ Girard, N; Mornex F (October 2011). «Stereotactic radiotherapy for non-small cell lung cancer:From concept to clinical reality. 2011 update». Cancer Radiothérapie 15 (6–7): 522–526. doi:. PMID 21889901.
- ↑ Fairchild, A; Harris K, Barnes E et al. (August 2008). «Palliative thoracic radiotherapy for lung cancer: a systematic review». Journal of Clinical Oncology 26 (24): 4001–4011. doi:. PMID 18711191. http://jco.ascopubs.org/content/26/24/4001.full.
- ↑ Hann CL, Rudin CM (2008-11-30). «Management of small-cell lung cancer:incremental changes but hope for the future». Oncology (Williston Park) 22 (13): 1486–92. PMID 19133604.
- ↑ Murray, N; Turrisi AT (March 2006). «A review of first-line treatment for small-cell lung cancer». Journal of Thoracic Oncology 1 (3): 270–278. PMID 17409868.
- ↑ Azim, HA; Ganti AK (March 2007). «Treatment options for relapsed small-cell lung cancer». Anticancer drugs 18 (3): 255–261. doi:. PMID 17264756.
- ↑ MacCallum, C; Gillenwater HH (July 2006). «Second-line treatment of small-cell lung cancer». Current Oncology Reports 8 (4): 258–264. doi:. PMID 17254525.
- ↑ 86,0 86,1 NSCLC Meta-Analyses Collaborative Group (October 2008). «Chemotherapy in Addition to Supportive Care Improves Survival in Advanced Non–Small-Cell Lung Cancer: A Systematic Review and Meta-Analysis of Individual Patient Data From 16 Randomized Controlled Trials». J. Clin. Oncol. 26 (28): 4617–25. doi:. PMID 18678835.
- ↑ Mehra R, Treat J (2008). Fishman's Pulmonary Diseases and Disorders (4th έκδοση). McGraw-Hill. σελ. 1876. ISBN 0-07-145739-9.
- ↑ 88,0 88,1 Clegg, A; Scott DA, Hewitson P et al. (January 2002). «Clinical and cost effectiveness of paclitaxel, docetaxel, gemcitabine, and vinorelbine in non-small cell lung cancer: a systematic review». Thorax (BMJ Publishing Group) 57 (1): 20–28. doi:. PMID 11809985.
- ↑ Fuld AD, Dragnev KH, Rigas JR (June 2010). «Pemetrexed in advanced non-small-cell lung cancer». Expert Opin Pharmacother 11 (8): 1387–402. doi:. PMID 20446853.
- ↑ Carbone, DP; Felip E (September 2011). «Adjuvant therapy in non-small cell lung cancer: future treatment prospects and paradigms». Clinical Lung Cancer 12 (5): 261–271. doi:. PMID 21831720.
- ↑ 91,0 91,1 Le Chevalier, T (October 2010). «Adjuvant chemotherapy for resectable non-small-cell lung cancer: where is it going?». Annals of Oncology 21 (Suppl. 7): vii196–198. doi:. PMID 20943614. http://annonc.oxfordjournals.org/content/21/suppl_7/vii196.long.
- ↑ Horn, L; Sandler AB, Putnam JB Jr, Johnson DH (May 2007). «The rationale for adjuvant chemotherapy in stage I non-small cell lung cancer». Journal of Thoracic Oncology 2 (5): 377–383. doi:. PMID 17473651.
- ↑ Wakelee, HA; Schiller JH, Gandara DR (July 2006). «Current status of adjuvant chemotherapy for stage IB non-small-cell lung cancer: implications for the New Intergroup Trial». Clinical Lung Cancer (Cancer Information Group) 8 (1): 18–21. doi:. PMID 16870041.
- ↑ BMJ (Δεκεμβρίου 2005). Clinical evidence concise : the international resource of the best available evidence for effective health care. London: BMJ Publishing Group. σελίδες 486–488. ISBN 1-905545-00-2. ISSN 1475-9225.
- ↑ Kelley AS, Meier DE (August 2010). «Palliative care—a shifting paradigm». New England Journal of Medicine 363 (8): 781–2. doi:. PMID 20818881.
- ↑ 96,0 96,1 Prince-Paul M (April 2009). «When hospice is the best option: an opportunity to redefine goals». Oncology (Williston Park, N.Y.) 23 (4 Suppl Nurse Ed): 13–7. PMID 19856592.
- ↑ Souquet PJ, Chauvin F, Boissel JP, Bernard JP (April 1995). «Meta-analysis of randomised trials of systemic chemotherapy versus supportive treatment in non-resectable non-small cell lung cancer». Lung Cancer 12 Suppl 1: S147–54. doi:. PMID 7551923.
- ↑ Sörenson S, Glimelius B, Nygren P (2001). «A systematic overview of chemotherapy effects in non-small cell lung cancer». Acta Oncol 40 (2–3): 327–39. PMID 11441939.
- ↑ Clegg A, Scott DA, Sidhu M, Hewitson P, Waugh N (2001). «A rapid and systematic review of the clinical effectiveness and cost-effectiveness of paclitaxel, docetaxel, gemcitabine and vinorelbine in non-small-cell lung cancer». Health Technol Assess 5 (32): 1–195. PMID 12065068.
- ↑ Πρότυπο:Cite Cochrane
- ↑ «Non-Small Cell Lung Cancer Treatment». PDQ for Health Professionals. National Cancer Institute. Ανακτήθηκε στις 22 Νοεμβρίου 2008.
- ↑ «Small Cell Lung Cancer Treatment». PDQ for Health Professionals. National Cancer Institute. 2012. Ανακτήθηκε στις 16 Μαΐου 2012.
- ↑ Spiro, SG (2010). «18.19.1». Oxford Textbook Medicine (5th έκδοση). OUP Oxford. ISBN 978-0199204854.
- ↑ SEER data (SEER.cancer.gov)Median Age of Cancer Patients at Diagnosis 2002-2003
- ↑ SEER data (SEER.cancer.gov)Median Age of Cancer Patients at Death 2002-2006
- ↑ Slatore, CG; Au DH, Gould MK (November 2010). «An official American Thoracic Society systematic review: insurance status and disparities in lung cancer practices and outcomes». American Journal of Respiratory and Critical Care Medicine 182 (9): 1195–1205. doi:. PMID 21041563. http://ajrccm.atsjournals.org/content/182/9/1195.long.
- ↑ «WHO Disease and injury country estimates». World Health Organization. 2009. Ανακτήθηκε στις 11 Νοεμβρίου 2009.
- ↑ Jemal A, Tiwari RC, Murray T, et al. (2004). «Cancer statistics, 2004». CA: a Cancer Journal for Clinicians 54 (1): 8–29. doi:. PMID 14974761.
- ↑ Proctor, RN (March 2012). «The history of the discovery of the cigarette-lung cancer link: evidentiary traditions, corporate denial, global toll». Tobacco Control 21 (2): 87–91. doi:. PMID 22345227.
- ↑ Lum, KL; Polansky JR, Jackler RK, Glantz SA (October 2008). «Signed, sealed and delivered: "big tobacco" in Hollywood, 1927–1951». Tobacco Control 17 (5): 313–323. doi:. PMID 18818225. PMC 2602591. http://tobaccocontrol.bmj.com/cgi/content/full/17/5/313.
- ↑ Lovato, C; Watts A, Stead LF (October 2011). «Impact of tobacco advertising and promotion on increasing adolescent smoking behaviours». Cochrane Database of Systematic Reviews (10): CD003439. doi:. PMID 21975739.
- ↑ Kemp, FB (Jul–Sep 2009). «Smoke free policies in Europe. An overview». Pneumologia 58 (3): 155–158. PMID 19817310.
- ↑ National Cancer Institute; SEER stat fact sheets: Lung and Bronchus. Surveillance Epidemiology and End Results. 2010[1]
- ↑ «Gender in lung cancer and smoking research» (PDF). World Health Organization. 2004. Ανακτήθηκε στις 26 Μαΐου 2007.
- ↑ Zhang, J; Ou JX, Bai CX (November 2011). «Tobacco smoking in China: prevalence, disease burden, challenges and future strategies». Respirology 16 (8): 1165–1172. doi:. PMID 21910781.
- ↑ Behera, D; Balamugesh T (2004). «Lung cancer in India» (PDF). Indian Journal of Chest Diseases and Allied Sciences 46 (4): 269–281. PMID 15515828. http://www.vpci.org.in/upload/Journals/pic130.pdf#page=27.
- ↑ Charloux, A; Quoix E, Wolkove N et al. (February 1997). «The increasing incidence of lung adenocarcinoma: reality or artefact? A review of the epidemiology of lung adenocarcinoma». International Journal of Epidemiology 26 (1): 14–23. doi:. PMID 9126499. http://ije.oxfordjournals.org/cgi/reprint/26/1/14.
- ↑ Kadara, H; Kabbout M, Wistuba II (January 2012). «Pulmonary adenocarcinoma: a renewed entity in 2011». Respirology 17 (1): 50–65. doi:. PMID 22040022.
- ↑ Morgagni, Giovanni Battista (1761). De sedibus et causis morborum per anatomen indagatis. OL 24830495M.
- ↑ Bayle, Gaspard-Laurent (1810). Recherches sur la phthisie pulmonaire (στα French). Paris. OL 15355651W.
- ↑ 121,0 121,1 Witschi, H (November 2001). «A short history of lung cancer». Toxicological Sciences 64 (1): 4–6. doi:. PMID 11606795. http://toxsci.oxfordjournals.org/cgi/content/full/64/1/4.
- ↑ Adler, I (1912). Primary Malignant Growths of the Lungs and Bronchi. New York: Longmans, Green, and Company. OCLC 14783544. OL 24396062M., cited in Spiro SG, Silvestri GA (2005). «One hundred years of lung cancer». American Journal of Respiratory and Critical Care Medicine 172 (5): 523–529. doi:. PMID 15961694.
- ↑ Grannis, FW. «History of cigarette smoking and lung cancer». smokinglungs.com. Αρχειοθετήθηκε από το πρωτότυπο στις 18 Ιουλίου 2007. Ανακτήθηκε στις 6 Αυγούστου 2007.
- ↑ Proctor, R (2000). The Nazi War on Cancer. Princeton University Press. σελίδες 173–246. ISBN 0-691-00196-0.
- ↑ Doll, R; Hill AB (November 1956). «Lung Cancer and Other Causes of Death in Relation to Smoking». British Medical Journal 2 (5001): 1071–1081. doi:. PMID 13364389.
- ↑ US Department of Health Education and Welfare (1964). «Smoking and health: report of the advisory committee to the Surgeon General of the Public Health Service» (PDF). Washington, DC: US Government Printing Office.
- ↑ 127,0 127,1 Greaves, M (2000). Cancer: the Evolutionary Legacy. Oxford University Press. σελίδες 196–197. ISBN 0-19-262835-6.
- ↑ Greenberg, M; Selikoff IJ (February 1993). «Lung cancer in the Schneeberg mines: a reappraisal of the data reported by Harting and Hesse in 1879». Annals of Occupational Hygiene 37 (1): 5–14. PMID 8460878.
- ↑ Samet, JM (April 2011). «Radiation and cancer risk: a continuing challenge for epidemiologists». Environmental Health 10 (Suppl. 1): S4. doi:. PMID 21489214.
- ↑ Horn, L; Johnson DH (July 2008). «Evarts A. Graham and the first pneumonectomy for lung cancer». Journal of Clinical Oncology 26 (19): 3268–3275. doi:. PMID 18591561. http://jco.ascopubs.org/cgi/pdf_extract/26/19/3268.
- ↑ Edwards, AT (1946). «Carcinoma of the Bronchus». Thorax 1 (1): 1–25. doi:. PMID 20986395.
- ↑ Kabela, M (1956). «Erfahrungen mit der radikalen Röntgenbestrahlung des Bronchienkrebses» (στα German). Ceskoslovenská Onkológia 3 (2): 109–115. PMID 13383622.
- ↑ Saunders, M; Dische S, Barrett A et al. (July 1997). «Continuous hyperfractionated accelerated radiotherapy (CHART) versus conventional radiotherapy in non-small-cell lung cancer: a randomised multicentre trial». Lancet (Elsevier) 350 (9072): 161–165. doi:. PMID 9250182.
- ↑ Lennox, SC; Flavell G, Pollock DJ et al. (November 1968). «Results of resection for oat-cell carcinoma of the lung». Lancet (Elsevier) 2 (7575): 925–927. doi:. PMID 4176258.
- ↑ Miller, AB; Fox W, Tall R (September 1969). «Five-year follow-up of the Medical Research Council comparative trial of surgery and radiotherapy for the primary treatment of small-celled or oat-celled carcinoma of the bronchus». Lancet (Elsevier) 2 (7619): 501–505. doi:. PMID 4184834.
- ↑ Cohen, M; Creaven PJ, Fossieck BE Jr et al. (1977). «Intensive chemotherapy of small cell bronchogenic carcinoma». Cancer Treatment Reports 61 (3): 349–354. PMID 194691.
