Πυρηνικός υποδοχέας

Στον τομέα της μοριακής βιολογίας, πυρηνικοί υποδοχείς είναι μια κατηγορία πρωτεϊνών που βρίσκονται στο εσωτερικό των κυττάρων. Οι πρωτεΐνες αυτές είναι υπεύθυνες για την ανίχνευση στεροειδών και θυροειδών ορμονών και κάποιων άλλων μορίων. Οι πυρηνικοί υποδοχείς λειτουργούν με άλλες πρωτεΐνες για να ρυθμίσουν την έκφραση συγκεκριμένων γονιδίων, ελέγχοντας έτσι την ανάπτυξη, ομοιόσταση, και το μεταβολισμό του οργανισμού.
Οι πυρηνικοί υποδοχείς έχουν την ικανότητα να προσδένονται άμεσα με το DNA και να ρυθμίζουν την έκφραση γειτονικών γονιδίων, και γι' αυτό αυτοί ταξινομούνται στους παράγοντες μεταγραφής.[2][3] Η ρύθμιση της έκφρασης ενός γονιδίου από πυρηνικούς υποδοχείς γενικά συμβαίνει μόνο υπό την παρουσία ενός συνδέτη (ligand) - μόριο που επηρεάζει τη συμπεριφορά του υποδοχέα -. Πιο συγκεκριμένα, ο συνδέτης συνδέεται με ένα πυρηνικό υποδοχέα διαμορφώνοντάς τον. Αυτό ενεργοποιεί τον υποδοχέα και οδηγεί στην αύξηση ή την μείωση της γονιδιακής έκφρασης.
Μία μοναδική ιδιότητα των πυρηνικών υποδοχέων που τα διαφοροποιεί από άλλες κατηγορίες υποδοχέων είναι η ικανότητά τους να αλληλεπιδρούν και να ελέγχουν άμεσα την έκφραση του γενωμικού DNA (γονιδιώματος). Κατά συνέπεια, οι πυρηνικοί υποδοχείς διαδραματίζουν βασικούς ρόλους στην εμβρυϊκή ανάπτυξη αλλά και στην ομοιόσταση ενηλίκων. Όπως θα συζητηθεί παρακάτω, οι πυρηνικοί υποδοχείς μπορούν να ταξινομηθούν σύμφωνα με το μηχανισμό[4][5] ή ομολογία.[6][7]
Κατανομή στα είδη[Επεξεργασία | επεξεργασία κώδικα]
Οι πυρηνικοί υποδοχείς εντοπίζονται μόνο στα μετάζωα (ζώα) και δεν βρίσκονται σε πρώτιστα, φύκη, μύκητες, ή τα φυτά.[8] (Από νωρίς ακόμη στη διακλάδωση των ειδών με γονιδίωμα, πυρηνικοί υποδοχείς εντοπίστηκαν: δύο στον σπόγγο Amphimedon queenslandica, δύο στη κτενοφόρο Mnemiopsis leidyi[9], τέσσερις στις placozoan adhaerens Trichoplax και 17 στην cnidarian vectensis Nematostella.[10] Υπάρχουν 270 πυρηνικοί υποδοχείς στον νηματώδη σκώληκα C. elegans.[11] οι άνθρωποι, τα ποντίκια και οι αρουραίοι έχουν αντίστοιχα 48, 49, και 47 πυρηνικούς υποδοχείς.[12]
Συνδέτες[Επεξεργασία | επεξεργασία κώδικα]

Συνδέτες που συνδέονται και ενεργοποιούν τους πυρηνικούς υποδοχείς περιλαμβάνουν λιπόφιλες ουσίες όπως ενδογενείς ορμόνες, βιταμίνες Α και D, και ξενοβιοτικές ουσίες που διαταράσσουν το ενδοκρινικό σύστημα. Όπως προαναφέραμε, η έκφραση πολλών γονιδίων ρυθμίζεται από τους πυρηνικούς υποδοχείς. Έτσι, οι συνδέτες που ενεργοποιούν αυτούς τους υποδοχείς επηρεάζουν σημαντικά τη λειτουργία του οργανισμού. Κάποια από τα γονίδια που ρυθμίζονται από τους πυρηνικούς υποδοχείς συνδέονται με διάφορες ασθένειες, πράγμα που εξηγεί το γιατί οι μοριακοί στόχοι περίπου των 13% των εγκεκριμένων από το U.S. Food and Drug Administration (FDA) φαρμάκων είναι πυρηνικοί υποδοχείς.[13]
Ένας αριθμός των πυρηνικών υποδοχέων, που αναφέρονται ως ορφανοί υποδοχείς (orphan receptors)[14], δεν έχουν γνωστούς (ή τουλάχιστον έτσι έχει γενικά συμφωνηθεί) ενδογενή συνδέτες. Ορισμένοι από αυτούς τους υποδοχείς, όπως FXR, LXR, και PPAR, δεσμεύουν έναν αριθμό μεταβολικών ενδιαμέσων όπως λιπαρά οξέα, τα χολικά οξέα και / ή στερόλες με σχετικά χαμηλή συγγένεια. Αυτοί οι υποδοχείς μπορούν συνεπώς λειτουργούν ως μεταβολικές αισθητήρες. Άλλοι πυρηνικοί υποδοχείς, όπως οι CAR και PXR εμφανίζονται να λειτουργούν ως αισθητήρες ξενοβιοτικών ουσιών, αυξάνοντας την έκφραση των ενζύμων του κυτοχρώματος Ρ450 που μεταβολίζουν τις ξενοβιοτικές αυτές ουσίες.[15]
Δομή[Επεξεργασία | επεξεργασία κώδικα]
Οι περισσότεροι πυρηνικοί υποδοχείς έχουν μοριακές μάζες από 50.000 μέχρι 100.000 daltons.
Οι πυρηνικοί υποδοχείς έχουν σπονδυλωτή/αρθρωτή δομή και περιέχουν τους ακόλουθους τομείς:[16][17]
- (A-B) Ν-τερματικό ρυθμιστικό πεδίο (N-terminal regulatory domain): Περιέχει τη λειτουργία ενεργοποίησης 1 (activation function 1) (AF-1) του οποίου η δράση είναι ανεξάρτητη από την παρουσία του συνδέτη.[18] Η AF-1 λειτουργεί μαζί με τη λειτουργία ενεργοποίησης AF-2 (τομέας E- είναι παρακάτω) και αυξάνει σημαντικά τη γονιδιακή έκφραση. Η αλληλουχία του τομέα AB είναι εξαιρετικά μεταβλητή μεταξύ των διαφόρων πυρηνικών υποδοχέων.
- (C) Περιοχή σύνδεσης DNA (DNA binding domain) (DBD): Είναι εξαιρετικά συντηρημένη περιοχή. Περιέχει δύο δακτυλίους ψευδαργύρου (zinc fingers) που συνδέονται με ειδικές αλληλουχίες του DNA που ονομάζονται στοιχεία απόκρισης στην ορμόνη (hormone response elements) (HRE).
- (D) Περιοχή άρθρωσης: Πιστεύεται ότι είναι μια ευέλικτη περιοχή που συνδέει την DBD με το LBD (είναι παρακάτω). Επηρεάζει την ενδοκυττάρια διακίνηση και την υποκυτταρική διανομή.
- (Ε) Περιοχή σύνδεσης με το συνδέτη (Ligand binding domain) (LBD): Μέτρια συντηρημένη σε αλληλουχία και εξαιρετικά διατηρημένη στην δομή μεταξύ των διαφόρων πυρηνικών υποδοχέων. Η περιοχή αυτή αποτελείται από α-έλικες οι οποίες αναδιπλώνονται. Η δομή της LBD αναφέρεται ως ένα άλφα ελικοειδή δίπλωσης σάντουιτς στην οποία τρεις αντιπαράλληλες α-έλικα (η "γέμιση σάντουιτς") πλαισιώνονται από δύο άλφα έλικες στη μία πλευρά και τρεις στην άλλη (το "ψωμί"). Η κοιλότητα συνδέσεως του υποδοχέα με τον συνδέτη βρίσκεται στο εσωτερικό της περιοχής LBD και ακριβώς κάτω των τριών αντιπαράλληλων άλφα ελικοειδών (δηλ. του γεμίσματος). Μαζί με την DBD, το LBD συμβάλλει στο διμερισμό του υποδοχέα και, επιπλέον, συνδέεται με συνενεργοποιητή και συγκαταστολέα πρωτεΐνη. Το LBD περιέχει επίσης τη λειτουργία ενεργοποίησης 2 (AF-2) του οποίου η δράση εξαρτάται από την παρουσία του συνδεδεμένου συνδέτη.[18]
- (F) C-τερματική περιοχή (C-terminal domain): Εξαιρετικά μεταβλητή σε αλληλουχία μεταξύ των διαφόρων πυρηνικών υποδοχέων.
Το Ν ρυθμιστικό πεδίο (A/B), η περιοχή σύνδεσης DNA (C) και η περιοχή σύνδεσης του συνδέτη (E) έχουν ανεξάρτητη και καλή αναδίπλωση, ενώ η περιοχή άρθρωσης (D) και η προαιρετική C- τερματική περιοχή (F) μπορεί να είναι αποδιοργανωμένες και εύκαμπτες.[19]
Μηχανισμός δράσης[Επεξεργασία | επεξεργασία κώδικα]


Οι πυρηνικοί υποδοχείς είναι πολυλειτουργικές πρωτεΐνες που μεταφέρουν σήματα από τους αντίστοιχους συνδέτες. Οι πυρηνικοί υποδοχείς (NRs) μπορούν να ταξινομηθούν σε δύο ευρείες κατηγορίες ανάλογα με το μηχανισμό δράσης τους και υποκυτταρική κατανομή σε απουσία συνδέτη.
Μικρές λιπόφιλες ουσίες όπως φυσικές ορμόνες διαπερνάν την κυτταρική μεμβράνη και συνδέονται με τους πυρηνικούς υποδοχείς που βρίσκονται στο κυτταρόπλασμα (τύπος Ι NR) ή στον πυρήνα (τύπου II NR) του κυττάρου. Αυτό προκαλεί μια αλλαγή στη διαμόρφωση του υποδοχέα, η οποία, ανάλογα με την μηχανιστική τάξη (τύπου Ι ή II), πυροδοτεί μια σειρά γεγονότων που τελικά οδηγούν σε αύξηση ή μείωση της γονιδιακής έκφρασης. Υπάρχουν και δύο επιπλέον κατηγορίες πυρηνικών υποδοχέων που συνδέονται με το DNA, η τύπου III η οποία είναι μια παραλλαγή του τύπου Ι, και η τύπου IV.[4].[4]
Συνεπώς, πυρηνικοί υποδοχείς μπορούν να υποδιαιρεθούν στις ακόλουθες τέσσερις κατηγορίες ανάλογα με τον μηχανισμό δράσης τους:[4][5]
Τύπος Ι[Επεξεργασία | επεξεργασία κώδικα]
Όταν ο συνδέτης συνδέεται με έναν πυρηνικό υποδοχέα τύπου Ι στο κυτταρόπλασμα πραγματοποιείται διάσπαση των πρωτεϊνών θερμικού σοκ, ομοδιμερισμός, μετατόπιση (ενεργός μεταφορά) από το κυτταρόπλασμα στον πυρήνα των κυττάρων, και σύνδεση με ειδικές αλληλουχίες DNA που είναι γνωστές ως στοιχεία απόκρισης ορμόνης hormone response elements (HREs). Οι τύπου 1 πυρηνικοί υποδοχείς συνδέονται με το HREs, το οποίο αποτελείται από δύο τμήματα, των οποίων οι αλληλουχίες είναι ανεστραμμένες επαναλήψεις, και ανάμεσα σε αυτά τα δύο τμήματα υπάρχει μία μεταβλητή αλληλουχία DNA. Οι τύπου Ι πυρηνικοί υποδοχείς περιλαμβάνουν μέλη της υποοικογένειας 3, όπως τον υποδοχέα ανδρογόνων, οιστρογόνων, γλυκοκορτικοειδών, και τον υποδοχέα προγεστερόνης.[20]
Έχει σημειωθεί ότι ορισμένες από τους πυρηνικούς υποδοχείς υποοικογένειας 2 μπορούν να συνδεθούν σε HREs των οποίων οι αλληλουχίες τω δύο τμημάτων είναι σε ευθεία επανάληψη (όχι ανεστραμμένη). Επιπλέον, ορισμένοι πυρηνικοί υποδοχείς προσδένονται, είτε ως μονομερή ή διμερή, σε ένα μόνο πεδίο σύνδεσης DNA (στο μισό HRE). Όσο για σήμερα, αυτές οι πυρηνικοί υποδοχείς θεωρούνται ορφανοί υποδοχείς, αφού οι ενδογενείς συνδέτες τους παραμένουν άγνωστοι.
Στη συνέχεια, κάποιες πρωτεΐνες συνδέονται μαζί με το σύμπλεγμα πυρηνικού υποδοχέα/DNA και μεταγράφεται έτσι το HRE σε αγγελιοφόρο RNA (mRNA) και τελικά παράγεται μία πρωτεΐνη (η οποία ενδεχομένως να προκαλέσει κάποια αλλαγή στη λειτουργία του κυττάρου).
Τύπος ΙΙ[Επεξεργασία | επεξεργασία κώδικα]
Οι υποδοχείς τύπου II, σε αντίθεση με του τύπου I συγκρατούνται στον πυρήνα, ανεξάρτητα από τον συνδέτη που είναι συνδεδεμένος σε αυτούς. Αυτοί οι υποδοχείς συνδέονται ως ετεροδιμερή (συνήθως με τον RXR) στο DNA. Χωρίς τον συνδέτη, οι υποδοχείς αυτοί δημιουργούν συνδέονται με συγκαταστολέα πρωτεΐνη. Με τον συνδέτη, προκαλεί διάσπαση του συγκαταστολέα και πρόσληψη πρωτεϊνών συνενεργοποιητές. Στη συνέχεια, επιπλέον πρωτεΐνες (συμπεριλαμβανομένης και της RNA πολυμεράσης) συγκεντρώνονται στο σύμπλοκο πυρηνικού υποδοχέα/ DNA και μεταγράφουν το DNA σε αγγελιοφόρο RNA.
Οι τύπου II πυρηνικοί υποδοχείς περιλαμβάνονται κυρίως στην υποοικογένεια 1. Παραδείγματα τέτοιων υποδοχέων είναι ο υποδοχέας ρετινοϊκού οξέος, ο υποδοχέας ρητινοειδούς Χ και ο υποδοχέας ορμόνης θυρεοειδούς.[21]
Τύπος ΙΙΙ[Επεξεργασία | επεξεργασία κώδικα]
Οι πυρηνικοί υποδοχείς τύπου ΙΙΙ (κυρίως υποοικογένεια 2) συνδέονται στο DNA ως ομοδιμερή, όπως γίνεται και τους υποδοχείς τύπου Ι. Ωστόσο, οι τύπου ΙΙΙ πυρηνικοί υποδοχείς, σε αντίθεση με του τύπου Ι, συνδέονται σε ευθεία και όχι ανεστραμμένη (HREs) επανάληψη.
Τύπος IV[Επεξεργασία | επεξεργασία κώδικα]
Οι τύπου IV πυρηνικοί υποδοχείς προσδένονται είτε ως μονομερή ή διμερή, αλλά μόνο μία περιοχή σύνδεσης DNA του υποδοχέα συνδέεται στο μισό τμήμα του HRE. Οι περισσότερες υποοικογένειες υποδοχέων περιλαμβάνουν και τέτοιους υποδοχείς.
Συν-ρυθμιστικές πρωτεΐνες[Επεξεργασία | επεξεργασία κώδικα]
Οι πυρηνικοί υποδοχείς συνδέονται στα στοιχεία απόκρισης ορμόνης (HRE) και δεσμεύουν ένα σημαντικό αριθμό άλλων πρωτεϊνών (που αναφέρονται ως συμπαράγοντες μεταγραφής) που διευκολύνουν ή αναστέλλουν τη μεταγραφή του αντίστοιχου γονιδίου.[22][23] Η λειτουργία αυτών των συμπαραγόντων ποικίλουν και περιλαμβάνουν αναδιαμόρφωση της χρωματίνης (καθιστώντας το γονίδιο είτε περισσότερο είτε λιγότερο προσιτό σε μεταγραφή) ή μια λειτουργία «γεφύρωσης» (bridging function) για να σταθεροποιηθεί/ διευκολυνθεί η σύνδεση άλλων πρωτεϊνών συρρύθμισης. Οι πυρηνικοί υποδοχείς μπορούν να συνδεθούν ειδικά σε ένα αριθμό πρωτεϊνών συρρύθμισης, και έτσι να επηρεάζουν τους κυτταρικούς μηχανισμούς μεταγωγής σήματος τόσο άμεσα, όσο και έμμεσα. [25]
Συνενεργοποιητές[Επεξεργασία | επεξεργασία κώδικα]
Η σύνδεση αγωνιστών συνδετών (βλέπε παρακάτω) με πυρηνικούς υποδοχείς προκαλεί μια διαμόρφωση του υποδοχέα, και ως αποτέλεσμα αυτός αρχίζει να δεσμεύει επιλεκτικά συνενεργοποιητές πρωτεϊνών. Αυτές οι πρωτεΐνες συχνά προκαλούν ακετυλίωση ιστονών. Έτσι εξασθενεί η σύνδεση των ιστονών με το DNA, και συνεπώς προάγεται η μεταγραφή του γονιδίου.
Συγκαταστολείς[Επεξεργασία | επεξεργασία κώδικα]
Η σύνδεση ανταγωνιστών συνδετών με τους πυρηνικούς υποδοχείς προκαλεί μια διαμόρφωση του υποδοχέα, και ως αποτέλεσμα αυτός αρχίζει να δεσμεύει επιλεκτικά συγκαταστολείς πρωτεΐνες. Αυτές οι πρωτεΐνες, με τη σειρά τους, προκαλούν αποακετυλίωση ιστονών. Έτσι ενισχύεται η σύνδεση των ιστονών με το DNA, και συνεπώς καταστέλλεται η μεταγραφή του γονιδίου.
Αγωνιστές vs ανταγωνιστές[Επεξεργασία | επεξεργασία κώδικα]
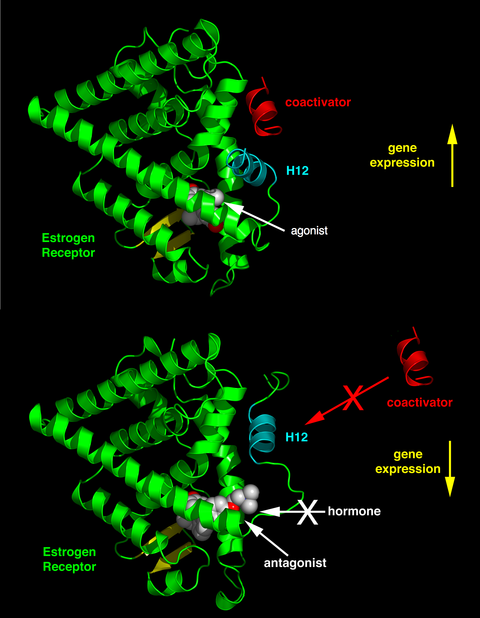
Ανάλογα με τον υποδοχέα, η χημική δομή του συνδέτη και του ιστού που επηρεάζεται, η συμπεριφορά του συνδέτη μπορεί να αλλάζει δραματικά. Έτσι ένας συνδέτης μπορεί, ανάλογα με τις συνθήκες, να είναι αγωνιστής, ανταγωνιστής ή αντίστροφος αγωνιστής.[26]
Αγωνιστές[Επεξεργασία | επεξεργασία κώδικα]
Οι ενδογενείς συνδέτες (όπως οι ορμόνες οιστραδιόλη και τεστοστερόνη) όταν συνδέονται με τους συγγενικούς πυρηνικούς υποδοχείς τους κανονικά διεγείρουν την έκφραση του γονιδίου. Αυτή η διέγερση της γονιδιακής έκφρασης από τον συνδέτη αναφέρεται ως μια απόκριση αγωνιστή (agonist response). Τα αγωνιστικά αποτελέσματα των ενδογενών αυτών ορμονών μπορούν επίσης να πραγματοποιηθούν με τη χρήση ορισμένων συνθετικών συνδετών, για παράδειγμα, του υποδοχέα γλυκοκορτικοειδών (glucocorticoid receptor) (GR) αντιφλεγμονώδους φαρμάκου δεξαμεθαζόνης (dexamethasone). Οι συνδέτες αγωνιστή λειτουργούν επάγοντας μια διαμόρφωση στον υποδοχέα η οποία ευνοεί τη σύνδεση με συνενεργοποιητές πρωτεΐνες. (βλέπε άνω ήμισυ του σχήματος προς τα δεξιά).
Ανταγωνιστές[Επεξεργασία | επεξεργασία κώδικα]
Κάποιοι άλλοι συνθετικοί συνδέτες πυρηνικών υποδοχέων δεν έχουν εμφανή επίδραση στην μεταγραφή γονιδίων όταν απουσιάζουν ενδογενείς συνδέτες. Ωστόσο, μπλοκάρουν την επίδραση του αγωνιστή καθώς συνδέονται ανταγωνιστικά στην ίδια θέση σύνδεσης του πυρηνικού υποδοχέα. Αυτοί οι συνδέτες αναφέρονται ως ανταγωνιστές. Ένα παράδειγμα φαρμάκου που χρησιμοποιεί ανταγωνιστές πυρηνικού υποδοχέα είναι η μιφεπριστόνη (mifepristone) η οποία συνδέεται με τους υποδοχείς γλυκοκορτικοειδών και προγεστερόνης αναστέλλοντας έτσι τη δραστηριότητα των ενδογενών ορμονών κορτιζόλη και προγεστερόνη αντίστοιχα. Οι συνδέτες ανταγωνιστές λειτουργούν επάγοντας μια διαμόρφωση του υποδοχέα που εμποδίζει συνενεργοποιητή και προωθεί τον συγκαταστολέα σύνδεσης (βλέπε κάτω ήμισυ του σχήματος προς τα δεξιά).
Αντίστροφοι αγωνιστές[Επεξεργασία | επεξεργασία κώδικα]
Κάποιοι πυρηνικοί υποδοχείς προωθούν ένα (σχετικά χαμηλό) επίπεδο μεταγραφής (που αναφέρεται επίσης ως βασική ή ιδιοσυστατική δραστικότητα) ακόμη και χωρίς την παρουσία συνδετών αγωνιστών. Οι συνθετικοί συνδέτες που μειώνουν αυτό το βασικό επίπεδο δραστηριότητας των πυρηνικών υποδοχέων είναι γνωστοί ως αντίστροφοι αγωνιστές.[27]
Επιλεκτικοί ρυθμιστές των υποδοχέων[Επεξεργασία | επεξεργασία κώδικα]
Κάποια φάρμακα, που η δράση τους σχετίζεται με τους πυρηνικούς υποδοχείς, εμφανίζουν απόκριση αγωνιστή σε κάποιους ιστούς και ανταγωνιστή σε άλλους ιστούς. Αυτό μπορεί να προσφέρει σημαντικά οφέλη αφού δίνει τη δυνατότητα στο φάρμακο να δράσει μόνο στους συγκεκριμένους ιστούς που επιθυμούμε, μειώνοντας έτσι τις παρενέργειες. Τα φάρμακα με το προφίλ του άλλοτε αγωνιστή και άλλοτε ανταγωνιστή ονομάζονται επιλεκτικοί ρυθμιστές των υποδοχέων (selective receptor modulators) (SRMs). Παραδείγματα τέτοιων ουσιών είναι οι επιλεκτικοί ρυθμιστές υποδοχέων ανδρογόνων (Selective Androgen Receptor Modulators) (SARMs), οι επιλεκτικοί ρυθμιστές υποδοχέων οιστρογόνου Selective Estrogen Receptor Modulators (SERMs) και οι επιλεκτικοί ρυθμιστές υποδοχέων της προγεστερόνης Selective Progesterone Receptor Modulators (SPRMs). Ο μηχανισμός δράσης των SRMs μπορεί να ποικίλει ανάλογα με τη χημική δομή του συνδέτη και του σχετικού υποδοχέα, ωστόσο πιστεύεται ότι πολλές SRMs δουλεύουν προωθώντας μια διαμόρφωση του υποδοχέα που είναι στενά ισορροπημένη μεταξύ αγωνισμού και ανταγωνισμού. Στους ιστούς όπου η συγκέντρωση του συνενεργοποιητή πρωτεϊνών είναι υψηλότερη από τους συγκαταστολείς, η ισορροπία μετατοπίζεται στην κατεύθυνση αγωνιστή. Αντιστρόφως σε ιστούς όπου κυριαρχούν συγκαταστολείς, ο συνδέτης συμπεριφέρεται ως ανταγωνιστής.[28]
Εναλλακτικοί μηχανισμοί[Επεξεργασία | επεξεργασία κώδικα]

Trans-καταστολή[Επεξεργασία | επεξεργασία κώδικα]
Ο πιο κοινός μηχανισμός της δράσης πυρηνικού υποδοχέα συνεπάγεται την άμεση σύνδεση του σε ένα στοιχείο απόκρισης ορμόνης του DNA. Ο μηχανισμός αυτός αναφέρεται ως trans-ενεργοποίηση (transactivation). Ωστόσο, μερικοί πυρηνικοί υποδοχείς όχι μόνο μπορούν να προσδένονται στο DNA, αλλά και σε άλλους παράγοντες μεταγραφής. Αυτό συχνά οδηγεί στην απενεργοποίηση του παράγοντα μεταγραφής, κάτι που είναι γνωστό ως trans-καταστολή (transrepression).[29] Ένα παράδειγμα ενός πυρηνικού υποδοχέα που είναι σε θέση να προκαλέσει καταστολή είναι ο υποδοχέας γλυκοκορτικοειδών (glucocorticoid receptor) (GR). Επιπλέον, ορισμένοι συνδέτες του GR γνωστοί ως Επιλεκτικοί Αγωνιστές Υποδοχέα Γλυκοκορτικοειδούς (Selective Glucocorticoid Receptor Agonists) (SEGRAs) είναι σε θέση να ενεργοποιήσουν την GR με τέτοιον τρόπο ώστε η λειτουργία καταστολής (transrepression) να υπερισχύει της λειτουργίας ενεργοποίησης (transactivation). Έτσι είναι δυνατή η εκμετάλλευση της αντιφλεγμονώδης δράσης αυτών των επιλεκτικών γλυκοκορτικοειδών αποφεύγοντας τις ανεπιθύμητες παρενέργειες του μεταβολισμού.
Μη-γονιδιακή[Επεξεργασία | επεξεργασία κώδικα]
Οι κλασσικές άμεσες λειτουργικές συνέπειες των πυρηνικών υποδοχέων όσον αφορά τη ρύθμιση του γονιδίου συνήθως παίρνουν ώρες για να πραγματοποιηθούν, επειδή μεσολαβούν πολλά ενδιάμεσα βήματα από τη στιγμή ενεργοποίησης του πυρηνικού υποδοχέα μέχρι την αλλαγή στην πρωτεϊνική έκφραση. Ωστόσο, έχει παρατηρηθεί ότι η εφαρμογή κάποιων ορμονών (όπως οιστρογόνα) δίνει αποτελέσματα μέσα σε λίγα λεπτά το οποίο δεν συμφωνεί με τον κλασικό μηχανισμό δράσης των πυρηνικών υποδοχέων. Η λειτουργία αυτών των πυρηνικών υποδοχέων (που ονομάστηκαν μη-γονιδιακοί) δεν έχει αποδειχθεί πιστά ακόμη. Ωστόσο κάποιοι υποστηρίζουν ότι αποτελούν παραλλαγές των πυρηνικών υποδοχέων που είναι συνδεδεμένοι με τη μεμβράνη, και δεν εντοπίζονται στο κυτταρόπλασμα ή στον πυρήνα. Αυτοί οι υποδοχείς που συνδέονται με τη μεμβράνη σχετίζονται με τη λειτουργία του εναλλακτικού μηχανισμού μεταγωγής σήματος, και δε σχετίζονται με τη ρύθμιση των γονιδίων.[30][31]
Οικογένειες υποδοχέων[Επεξεργασία | επεξεργασία κώδικα]
Για μια λίστα επιλεγμένων υποδοχέων, ταξινομιμένων σύμφωνα με την ομολογία αλληλουχίας ανατρέξτε στο Αγγλικό άρθρο της Wikipedia (Family members).[6][7]
Ιστορία[Επεξεργασία | επεξεργασία κώδικα]
Κάποια σημαντικά γεγονότα στην ιστορία της έρευνας για τους πυρηνικούς υποδοχείς:[32]
- 1905 - Ο Ernest Starling χρησιμοποίησε τη λέξη ορμόνη (hormone)
- 1926 – Οι Edward Calvin Kendall και Tadeus Reichstein απομόνωσαν και ανακάλυψαν τις δομές της κορτιζόνης και της θυροξίνης.
- 1929 – Οι Adolf Butenandt and Edward Adelbert Doisy ανεξάρτητα ο ένας από τον άλλον απομόνωσαν και ανακάλυψαν τη δομή των οιστρογόνων.
- 1958 – Ο Elwood Jensen απομόνωσε τον υποδοχέα των οιστρογόνων.
- δεκαετία του 1980 – πραγματοποιήθηκε κλωνοποίηση των υποδοχέων των οιστρογόνων, των γλυκοκορτικοειδών και των θυρεοειδών ορμονών από τους Pierre Chambon, Ronald Evans, και Björn Vennström αντίστοιχα.
- 2004 – Οι Pierre Chambon, Ronald Evans, και Elwood Jensen πήραν το βραβείο Albert Lasker Award for Basic Medical Research, ένα βραβείο που ίσως θεωρείται ανώτερο από το βραβείο Nobel στην Ιατρική.
Παραπομπές[Επεξεργασία | επεξεργασία κώδικα]
- ↑ PDB 3E00; «Structure of the intact PPAR-gamma-RXR-alpha nuclear receptor complex on DNA». Nature 456 (7220): 350–356. October 2008. doi:. PMID 19043829.
- ↑ «The steroid and thyroid hormone receptor superfamily». Science 240 (4854): 889–95. 1988. doi:. PMID 3283939.
- ↑ «Nuclear receptor minireview series». J. Biol. Chem. 276 (40): 36863–4. 2001. doi:. PMID 11459855.
- ↑ 4,0 4,1 4,2 «The nuclear receptor superfamily: the second decade». Cell 83 (6): 835–9. 1995. doi:. PMID 8521507.
- ↑ 5,0 5,1 «Nuclear receptors: overview and classification». Curr Drug Targets Inflamm Allergy 3 (4): 335–46. 2004. doi:. PMID 15584884. http://www.ingentaconnect.com/content/ben/cdtia/2004/00000003/00000004/art00002.
- ↑ 6,0 6,1 «A unified nomenclature system for the nuclear receptor superfamily». Cell 97 (2): 161–3. 1999. doi:. PMID 10219237.
- ↑ 7,0 7,1 «Evolution of the nuclear receptor superfamily: early diversification from an ancestral orphan receptor». J. Mol. Endocrinol. 19 (3): 207–26. 1997. doi:. PMID 9460643.
- ↑ «Evolution and diversification of the nuclear receptor superfamily». Annals of the New York Academy of Sciences 839: 143–6. May 1998. doi:. PMID 9629140.
- ↑ «Nuclear receptors from the ctenophore Mnemiopsis leidyi lack a zinc-finger DNA-binding domain: lineage-specific loss or ancestral condition in the emergence of the nuclear receptor superfamily?». Evodevo 2 (1): 3. 2011. doi:. PMID 21291545.
- ↑ «Protein evolution by molecular tinkering: diversification of the nuclear receptor superfamily from a ligand-dependent ancestor». PLoS Biol. 8 (10): e1000497. 2010. doi:. PMID 20957188.
- ↑ «Nuclear receptors in nematodes: themes and variations». Trends in Genetics : TIG 17 (4): 206–13. April 2001. doi:. PMID 11275326.
- ↑ «Genomic analysis of the nuclear receptor family: new insights into structure, regulation, and evolution from the rat genome». Genome Res 14 (4): 580–90. 2004. doi:. PMID 15059999.
- ↑ «How many drug targets are there?». Nature reviews. Drug discovery 5 (12): 993–6. 2006. doi:. PMID 17139284.
- ↑ «International Union of Pharmacology. LXVI. Orphan nuclear receptors». Pharmacol. Rev. 58 (4): 798–836. 2006. doi:. PMID 17132856.
- ↑ «Orphan nuclear receptor modulators». Curr Top Med Chem 3 (14): 1637–47. 2003. doi:. PMID 14683519.
- ↑ «The structure of the nuclear hormone receptors». Steroids 64 (5): 310–9. 1999. doi:. PMID 10406480. https://archive.org/details/sim_steroids_1999-05_64_5/page/310.
- ↑ «Estrogen receptor interaction with co-activators and co-repressors». Steroids 65 (5): 227–51. 2000. doi:. PMID 10751636.
- ↑ 18,0 18,1 «Activation functions 1 and 2 of nuclear receptors: molecular strategies for transcriptional activation». Mol. Endocrinol. 17 (10): 1901–9. 2003. doi:. PMID 12893880.
- ↑ Weatherman RV, Fletterick RJ, Scanlan TS (1999). «Nuclear-receptor ligands and ligand-binding domains». Annu. Rev. Biochem. 68: 559–81. doi:. PMID 10872460. https://archive.org/details/sim_annual-review-of-biochemistry_1999_68/page/559.
- ↑ «Expression of androgen receptor coregulators in prostate cancer». Clin. Cancer Res. 10 (3): 1032–40. February 2004. doi:. PMID 14871982.
- ↑ «Binding of type II nuclear receptors and estrogen receptor to full and half-site estrogen response elements in vitro». Nucleic Acids Res. 25 (10): 1903–12. May 1997. doi:. PMID 9115356.
- ↑ «The coregulator exchange in transcriptional functions of nuclear receptors». Genes Dev 14 (2): 121–41. 2000. doi:. PMID 10652267. http://genesdev.cshlp.org/content/14/2/121.long.
- ↑ «Nuclear hormone receptors and gene expression» (abstract). Physiol. Rev. 81 (3): 1269–304. 2001. PMID 11427696. http://physrev.physiology.org/cgi/content/abstract/81/3/1269.
- ↑ «Molecular basis of agonism and antagonism in the oestrogen receptor». Nature 389 (6652): 753–8. 1997. doi:. PMID 9338790.
- ↑ «The structural basis of estrogen receptor/coactivator recognition and the antagonism of this interaction by tamoxifen». Cell 95 (7): 927–37. 1998. doi:. PMID 9875847.
- ↑ «Principles for modulation of the nuclear receptor superfamily». Nature reviews. Drug discovery 3 (11): 950–64. 2004. doi:. PMID 15520817.
- ↑ «Identification of a selective inverse agonist for the orphan nuclear receptor estrogen-related receptor alpha». J. Med. Chem. 47 (23): 5593–6. 2004. doi:. PMID 15509154.
- ↑ «Coregulator function: a key to understanding tissue specificity of selective receptor modulators». Endocr Rev 25 (1): 45–71. 2004. doi:. PMID 14769827.
- ↑ «Nuclear receptors versus inflammation: mechanisms of transrepression». Trends Endocrinol Metab 17 (8): 321–7. 2006. doi:. PMID 16942889.
- ↑ «Estrogen receptor-dependent activation of AP-1 via non-genomic signalling». Nucl Recept 2 (1): 3. 2004. doi:. PMID 15196329.
- ↑ «Membrane estrogen receptor-alpha levels in MCF-7 breast cancer cells predict cAMP and proliferation responses». Breast Cancer Res. 7 (1): R101–12. 2005. doi:. PMID 15642158.
- ↑ «One hundred years of hormones». EMBO Rep. 6 (6): 490–6. 2005. doi:. PMID 15940278.
Εξωτερικοί σύνδεσμοι[Επεξεργασία | επεξεργασία κώδικα]
Για εξωτερικούς σύνδεσμους ανατρέξτε στο αντίστοιχο αγγλικό λήμμα: https://en.wikipedia.org/wiki/Nuclear_receptor[νεκρός σύνδεσμος]
| Στο λήμμα αυτό έχει ενσωματωθεί κείμενο από το λήμμα Nuclear receptor της Αγγλικής Βικιπαίδειας, η οποία διανέμεται υπό την GNU FDL και την CC-BY-SA 4.0. (ιστορικό/συντάκτες). |

