Προπενόνη
| Προπενόνη | |||
|---|---|---|---|
| Γενικά | |||
| Όνομα IUPAC | Προπενόνη | ||
| Άλλες ονομασίες | Μεθυλοκετένη | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C3H4O | ||
| Μοριακή μάζα | 56,063301 amu[1] | ||
| Σύντομος συντακτικός τύπος |
CH3CH=C=O | ||
| SMILES | CC=C=O | ||
| ChemSpider ID | 122256 | ||
| Δομή | |||
| Ισομέρεια | |||
| Ισομερή θέσης | 12 | ||
| Φυσικές ιδιότητες | |||
| Σημείο βρασμού | -8,933 °C | ||
| Πυκνότητα | 757 kg/m³ | ||
| Εμφάνιση | Άχρωμο αέριο | ||
| Χημικές ιδιότητες | |||
| Ελάχιστη θερμοκρασία ανάφλεξης |
−64,608°C | ||
| Επικινδυνότητα | |||
| Ιδιότητες εκρηκτικού | |||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Η προπενόνη ή μεθυλοκετένη (αγγλικά: propenone) είναι οργανική Χημική ένωση, που περιέχει άνθρακα, οξυγόνο και υδρογόνο, με μοριακό τύπο C3H4O, αν και συχνά γράφεται πιο αναλυτικά ως CH3CH=CO. Είναι μια κετένη.
Ισομέρεια[Επεξεργασία | επεξεργασία κώδικα]
Με βάση το μοριακό της τύπο, C3H4Ο έχει τα ακόλουθα δώδεκα (12) ισομερή θέσης:
- 1-προπινόλη (ελάσσων ταυτομερές της προπενόνης]) με σύντομο συντακτικό τύπο CH3C ≡ COH.
- 2-προπινόλη με σύντομο συντακτικό τύπο HC ≡ CCH2OH.
- Προπαδιενόλη (ελάσσων ταυτομερές της 2-προπενάλης) με σύντομο συντακτικό τύπο H2C=C=CHOH.
- 1-κυκλοπροπενόλη (ελάσσων ταυτομερές της κυκλοπροπανόνης) με σύντομο συντακτικό τύπο
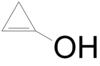
- 2-Κυκλοπροπενόλη με σύντομο συντακτικό τύπο

- Αιθινυλομεθυλαιθέρας ή μεθοξυαιθίνιο με σύντομο συντακτικό τύπο HC ≡ COCH3.
- Οξετένιο ή 1,3-εποξυπροπένιο με σύντομο συντακτικό τύπο
 .
. - Μεθυλοξιρένιο ή 1,2-εποξυπροπένιο με σύντομο συντακτικό τύπο
 .
. - Μεθυλενοξιράνιο ή 2,3-εποξυπροπένιο με σύντομο συντακτικό τύπο
 .
. - Οξαδικυκλοβουτάνιο ή 1,2-εποξυκυκλοπροπάνιο με σύντομο συντακτικό τύπο
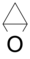 .
. - Προπενάλη με σύντομο συντακτικό τύπο CH2=CHCHO.
- Κυκλοπροπανόνη (κύριο ταυτομερές της 1-κυκλοπροπενόλης) με σύντομο συντακτικό τύπο

Δομή[Επεξεργασία | επεξεργασία κώδικα]
| Δεσμοί[2] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C-H | σ | 2sp²-1s | 107 pm | 3% C- H+ |
| C=O | σ | 2sp-2sp² | 129 pm | 19% C+ O- |
| π | 2p-2p | |||
| C=C | σ | 2sp²-2sp | 131 pm | |
| π | 2p-2p | |||
| C-C | σ | 2sp³-2sp² | 151 pm | |
| Στατιστικό ηλεκτρικό φορτίο[3] | ||||
| O | -0,38 | |||
| C#3 | -0,09 | |||
| C#2 | -0,03 | |||
| H | +0,03 | |||
| C#1 | +0,38 | |||
Παραγωγή[Επεξεργασία | επεξεργασία κώδικα]
Με αφυδάτωση[Επεξεργασία | επεξεργασία κώδικα]
Με ενδομοριακή αφυδάτωση προπανικού οξέος, παράγεται προπενόνη[4]:
Με απόσπαση υδραλογόνου[Επεξεργασία | επεξεργασία κώδικα]
Με απόσπαση υδραλογόνου (HX) από προπανοϋλαλογονίδιο παράγεται προπενόνη:
Με υδρόλυση 1-αλο-1-προπινίου[Επεξεργασία | επεξεργασία κώδικα]
Με υδρόλυση 1-αλο-1-προπινίου (CH3C ≡ CX) με αραιό διάλυμα υδροξειδίου του νατρίου (NaOH), παράγεται αρχικά 1-προπινόλη, που ταυτομερίζεται τελικά προς προπενόνη[5]:
Χημικές ιδιότητες και παράγωγα[Επεξεργασία | επεξεργασία κώδικα]
Ταυτομέρεια με 1-προπινόλη[Επεξεργασία | επεξεργασία κώδικα]
Η αιθενάλη βρίσκεται πάντα σε χημική ισορροπία με την ταυτομερή της 1-προπινόλη.[6]:
Αντιδράσεις με πυρηνόφιλα αντιδραστήρια[Επεξεργασία | επεξεργασία κώδικα]
Η προπενόνη αντιδρά με διάφορα πυρηνόφιλα αντιδραστήρια[7]. Π.χ.:
1. Με νερό δίνει προπανικό οξύ:
2. Με αλκοόλη (ROH) δίνει προπανικό αλκυλεστέρα:
3. Με αμμωνία δίνει προπαναμίδιο:
4. Με πρωτοταγείς αμίνες (RNH2) δίνει προπαναλκυλαμίδιο:
5. Με πρωτοταγείς καρβοξυλικά οξέα (RCOOH) δίνει αλκανικό προπιονυλεστέρα:
Διμερισμός[Επεξεργασία | επεξεργασία κώδικα]
Διμερίζεται σχηματίζοντας 4-αιθυλιδεν-2-οξοξετάνιο[8]:
4-αιθυλιδεν-2-οξοξετάνιο
Αναφορές και σημειώσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Διαδικτυακός τόπος ChemSpider
- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
- ↑ Υπολογισμένο βάση του ιονισμού από τον παραπάνω πίνακα
- ↑ J. Schmidlin, M. Bergman, Ber. dtsch. Chem. Ges., 43, 2821 (1910).
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 186, §7.3.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.223, §9.8.Γ1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.223, §9.8.Γ2.
Πηγές[Επεξεργασία | επεξεργασία κώδικα]
- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Δημήτριου Ν. Νικολαΐδη: Ειδικά μαθήματα Οργανικής Χημείας, Θεσσαλονίκη 1983.
| ||||||||







![{\displaystyle \mathrm {CH_{3}CH_{2}COX+Et_{3}N{\xrightarrow {}}CH_{3}CH=CO+[Et_{3}NH]X} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/0b56f9857c1e9a784edb55566a62e972130e6a64)







