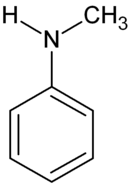
N-μεθυλανιλίνη
| N-μεθυλανιλίνη | |||
|---|---|---|---|
| |||
| Γενικά | |||
| Όνομα IUPAC | N-μεθυλανιλίνη | ||
| Άλλες ονομασίες | Μεθυλαμινοβενζόλιο Μεθυλοφαινυλαμίνη N-μεθυλοβενζεναμίνη | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C7H9N | ||
| Μοριακή μάζα | 107,15306 amu | ||
| Σύντομος συντακτικός τύπος |
C6H5NHCH3 | ||
| Συντομογραφίες | PhNHMe, ΦNHMe | ||
| Αριθμός CAS | 100-61-8 | ||
| SMILES | CNc1ccccc1 | ||
| Δομή | |||
| Ισομέρεια | |||
| Ισομερή θέσης | >100 | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | -57 °C | ||
| Σημείο βρασμού | 194-196 °C | ||
| Πυκνότητα | 990 kg/m3 | ||
| Διαλυτότητα στο νερό |
αδιάλυτη | ||
| Εμφάνιση | άχρωμο υγρό | ||
| Χημικές ιδιότητες | |||
| Επικινδυνότητα | |||

| |||
| Τοξική (T) | |||
| Φράσεις κινδύνου | R20-R21-R22-R23/24/25-R33 | ||
| Φράσεις ασφαλείας | S28-S37-S45 | ||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Η N-μεθυλανιλίνη ή μεθυλαμινοβενζόλιο ή μεθυλοφαινυλαμίνη ή N-μεθυλοβενζεναμίνη είναι μια δευτεροταγής αρωματική αμίνη, παράγωγη της ανιλίνης. Είναι μια τοξική οργανική ένωση με χημικό τύπο C7H9N και σύντομο συνακτικό τύπο C6H5NHCH3 ή συντομογραφικά PhNHMe. Στις «συνηθισμένες συνθήκες» (T = 25οC, P = 1 atm) είναι ένα άχρωμο ή ελαφρά κίτρινο ιξώδες (πηκτό) υγρό, αδιάλυτο στο νερό που γίνεται σταδιακά καφέ, όταν εκτίθεται στον ατμοσφαιρικό αέρα. Χρησιμοποιείται ως διαλύτης και ως ενδιάμεση ύλη για την παραγωγή βερνικιών, αγροχημικών και άλλων οργανικών βιομηχανικών προϊόντων.
Παραγωγή[Επεξεργασία | επεξεργασία κώδικα]
Από φαινυλαλογονίδιο[Επεξεργασία | επεξεργασία κώδικα]
Μέθοδος Hoffmann[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση μεθαναμίνης σε φαινυλαλογονίδιο[1][2]:
- Μειονόκτημα της μεθόδου είναι ότι συμπαράγονται διφαινυλαμίνη και τριφαινυλαμίνη ακόμη και αλογονούχο τετραφαινυλαμμώνιο[3].
Με αντιδραστήρια Grignard[Επεξεργασία | επεξεργασία κώδικα]
Μέσω οργανομαγνησιακών ενώσεων και μεθυλοχλωραμίνης[4]:
Αποικοδόμηση N-μεθυλοβενζαμιδίου[Επεξεργασία | επεξεργασία κώδικα]
Με αποικοδόμηαη N-μεθυλοβενζαμίδιου κατά Hofmann[5]:
Μεθυλαμίνωση βενζολίου[Επεξεργασία | επεξεργασία κώδικα]
Αμίνωση βενζολίου κατά Friedel-Crafts προς ανιλίνη:
Χημική συμπεριφορά και παράγωγα[Επεξεργασία | επεξεργασία κώδικα]
Οξεοβασική συμπεριφορά[Επεξεργασία | επεξεργασία κώδικα]
1. Συμπεριφορά βάσης - Παράγει άλατα με οξέα[6].:
2. Συμπεριφορά οξέος - Παράγει άλατα με ισχυρές βάσεις[7]:
Αλκυλίωση αμινομάδας[Επεξεργασία | επεξεργασία κώδικα]
Με αλκυλαλογονίδια[8].:
- Η αντίδραση γίνεται ευκολότερα με αλκυλοϊωδίδια.
Ακυλίωση αμινομάδας[Επεξεργασία | επεξεργασία κώδικα]
1. Με ακυλαλογονίδια[9].:
2. Με ανυδρίτες καρβονικών οξέων[10]:
Προσθήκη[Επεξεργασία | επεξεργασία κώδικα]
1. Προσθήκη σε διπλούς δεσμούς. Π.χ. με αιθένιο δίνει N-αιθυλo-N-μεθυλανιλίνη:
2. Προσθήκη σε τριπλούς δεσμούς.. Π.χ. με αιθίνιο δίνει N-βινυλo-N-μεθυλανιλίνη:
Αντιδράσεις του αρωματικού δακτυλίου[Επεξεργασία | επεξεργασία κώδικα]
- Η παρουσία της μεθυλαμινομάδας ενεργοποιεί τον βενζολικό δακτύλιο, οπότε οι αντίστοιχες αντιδράσεις γίνονται ταχύτερα σε σχέση με το βενζόλιο και παράγονται όχι μόνο ο- και π- διπαράγωγα, αλλά συχνά και πολυπαράγωγα της ανιλίνης. Ορισμένα όμως αντιδραστήρια προσβάλλουν πρώτα τη μεθυλαμινομάδα. Σ' αυτήν την περίπτωση χρειάζεται «προστασία» της, συνήθως με οξικό ανυδρίτη. Η παρουσία της ακετυλομάδας όμως απενεργοπποιεί κάπως το σύστημα, οπότε ελαχιστοποιείται η παραγωγή πολυπαραγώγων και παρεμποδίζεται στερεοχημικά την παραγωγή ο-παραγώγων της ανιλίνης. ΄Τέλος με παρουσία οξέων σχηματίζεται πρωτονιώνεται η μεθυλαμινομάδα και απενεργοποιείται ο αρωματικός δακτύλιος, με αποτέλεσμα να σχηματίζονται κυρίως μ-παράγωγα της ανιλίνης[11].
Π.χ. Με νίτρωση παράγει:
- α. N-μεθυλο-π-νιτροανιλίνη με προστασία[12]:
- β. N-μεθυλο-μ-νιτροανιλίνη χωρίς προστασία[16].
(Ν-μεθυλο-μ-νιτροανιλίνη)
Σημειώσεις και αναφορές[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ. 243, §10.2.Α.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999: Σελ. 324, §18.2.1,
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999: Σελ. 324, §18.2.2,
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ. 243, §10.2.Β4.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999: Σελ. 325, §18.2Δ,
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ. 245, §10.5.1. και §10.5.2α.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999: Σελ. 329, §18.3ΑΠρ8.16. και Πρ8.18.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ. 243, §10.2Α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ. 245, §10.5.4.
- ↑ 10,0 10,1 SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999: Σελ. 331, §18.3Γ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ. 398, §18.5.5ΑΒ και SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999: Σελ. 334, §18.3H.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999: Σελ. 334, §18.3H3.
- ↑ Προστασία αμινομάδας.
- ↑ Μόνο π-νίτρωση παραγώγου λόγω στερεοχημικής παρεμπόδισης της ο-νίτρωσης από την αρκετά ογκώδη ακετυλομεθυλοαμινομάδα.
- ↑ Αποπροστασία αμινομάδας.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ. 398, §18.5.5Β
Πηγές[Επεξεργασία | επεξεργασία κώδικα]
- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
| |||||||||||||||||||||||||||||||||||






![{\displaystyle \mathrm {PhCH_{3}+HCl{\xrightarrow {}}[PhNH_{2}^{+}CH_{3}]Cl^{-}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/c1db07fa335b571bd1cebfafab7c7a0d16c99807)

![{\displaystyle \mathrm {PhNHCH_{3}+KOH{\xrightarrow {}}[PhN-CH_{3}]K^{+}+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/20a68db57c799268cd9066e2f021a4b4c0cf4c62)









